Содержание
- 2. Электролиты - вещества, диссоциирующие на ионы при взаимодействии с растворителем и сообщающие раствору способность проводить электрический
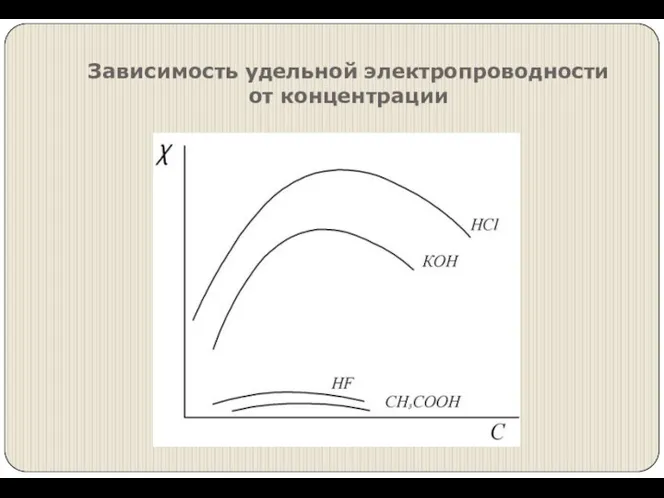
- 4. Зависимость удельной электропроводности от концентрации
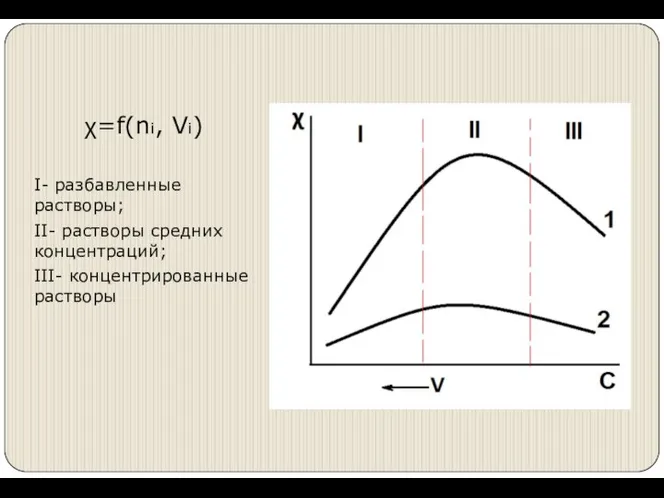
- 5. χ=f(ni, Vi) I- разбавленные растворы; II- растворы средних концентраций; III- концентрированные растворы
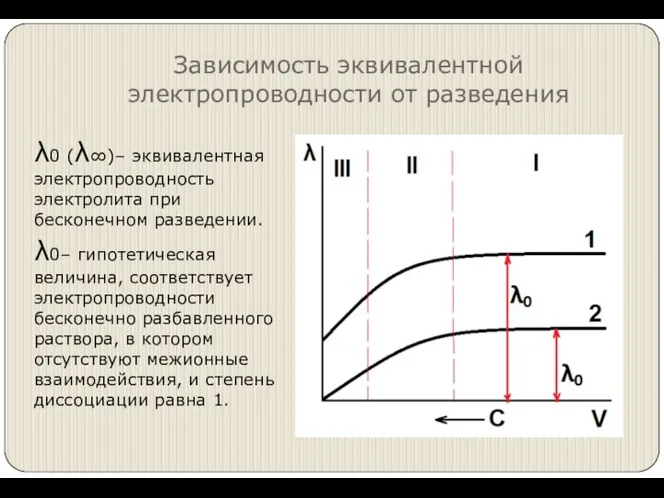
- 8. Зависимость эквивалентной электропроводности от разведения λ0 (λ∞)– эквивалентная электропроводность электролита при бесконечном разведении. λ0– гипотетическая величина,
- 10. При бесконечном разведении растворов кулоновские силы исчезают, величины ионных подвижностей стремятся к предельным значениям.
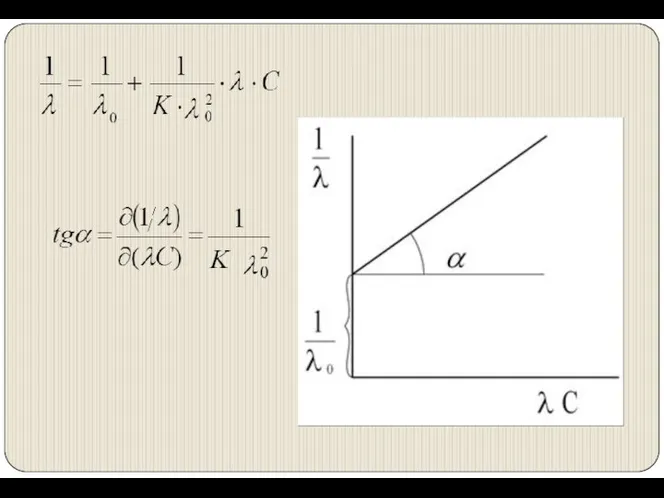
- 11. Зависимость электропроводности электролитов от концентрации при Т=const Разбавленные растворы сильных электролитов подчиняются закону Кольрауша: А –
- 12. Растворы слабых электролитов подчиняются закону разведения Оствальда.
- 15. Движение ионов в электрическом поле. Числа переноса ионов
- 19. Влияние природы электролита (иона и парного иона)
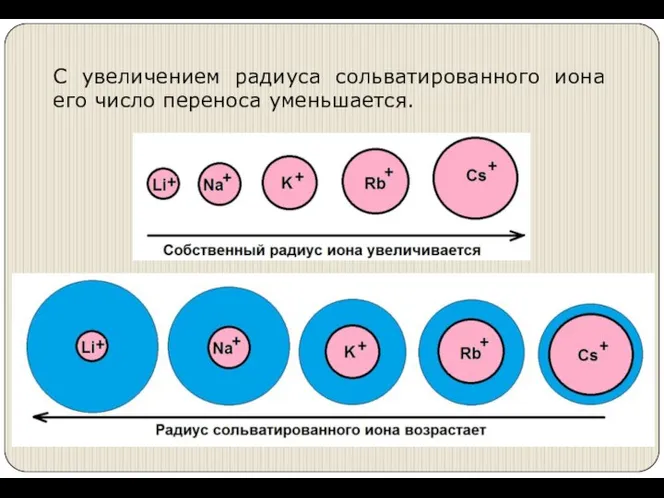
- 20. С увеличением радиуса сольватированного иона его число переноса уменьшается.
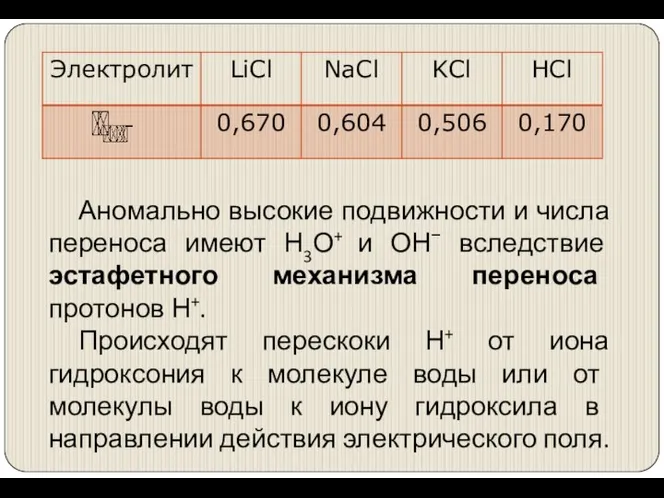
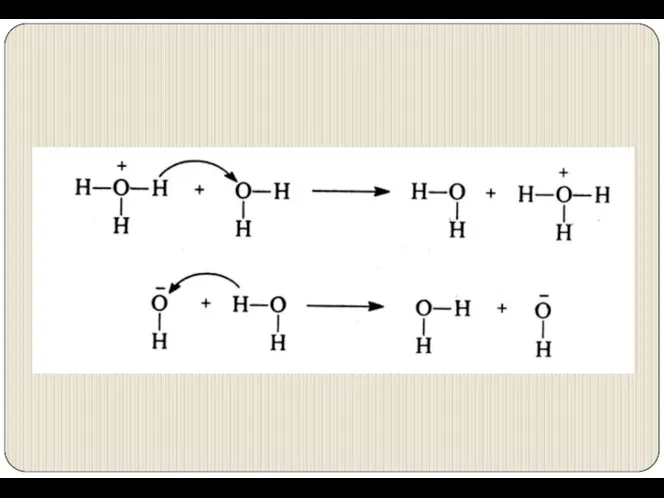
- 21. Аномально высокие подвижности и числа переноса имеют Н3О+ и ОН− вследствие эстафетного механизма переноса протонов Н+.
- 23. Влияние температуры. С ростом температуры снижается вязкость раствора; происходит десольватация ионов; числа переноса катиона и аниона
- 25. Скачать презентацию















 Строение, свойства, биологическая роль дезоксисахаров и аминосахаров
Строение, свойства, биологическая роль дезоксисахаров и аминосахаров Кремний и его соединения
Кремний и его соединения Основания. 8 класс
Основания. 8 класс Диссоциация. Уравнения диссоциации
Диссоциация. Уравнения диссоциации Предмет биоорганической химии. Лекция 1
Предмет биоорганической химии. Лекция 1 Презентация по Химии "Здоровьесберегающие технологии при изучении химии"
Презентация по Химии "Здоровьесберегающие технологии при изучении химии"  Типы изомерии
Типы изомерии Презентация на тему Факторы, влияющие на скорость химической реакции
Презентация на тему Факторы, влияющие на скорость химической реакции  Основания. Классификация
Основания. Классификация Сероводород. Сульфиды
Сероводород. Сульфиды Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Коррозия металлов, сплавов
Коррозия металлов, сплавов Производство полимеров в РК
Производство полимеров в РК Основания. Щелочи – растворимые основания
Основания. Щелочи – растворимые основания Классификация неорганических веществ
Классификация неорганических веществ Химический состав клетки
Химический состав клетки Химия в быту
Химия в быту Кислоты в химии
Кислоты в химии 9_OSNOVY_KOLANALIZA (1)
9_OSNOVY_KOLANALIZA (1) Химик белемнәрне тормышта куллану
Химик белемнәрне тормышта куллану Презентация на тему Глюкоза (10 класс)
Презентация на тему Глюкоза (10 класс)  Галогеноводородные кислоты
Галогеноводородные кислоты Оксиды. 8 класс
Оксиды. 8 класс Очистка рабочих электродов
Очистка рабочих электродов Техника безопасности на уроках химии
Техника безопасности на уроках химии Спирты. Понятие о спиртах
Спирты. Понятие о спиртах Презентация на тему Сахароза
Презентация на тему Сахароза  Практическая работа: наблюдение роста кристалов
Практическая работа: наблюдение роста кристалов