Содержание
- 2. Сегодня мы будем рассматривать, как взаимодействуют между собой атомы элементов-неметаллов. Возможно два случая: взаимодействуют атомы ОДНОГО
- 3. На прошлом уроке объяснялось, что образование любой ХИМИЧЕСКОЙ СВЯЗИ принято показывать с помощью СХЕМ ОБРАЗОВАНИЯ ХИМИЧЕСКОЙ
- 4. Согласно правилу, приведённому в вашем параграфе, «число неспаренных» электронов вычисляется по формуле: 8-№ группы Для С
- 5. Теперь можно посмотреть как будут взаимодействовать атомы, у которых на внешнем энергетическом уровне 2 неспаренных электрона,
- 6. Теперь рассмотрим как будут взаимодействовать атомы, у которых на внешнем энергетическом уровне 3 неспаренных электрона, например,
- 8. Скачать презентацию
Слайд 2Сегодня мы будем рассматривать, как взаимодействуют между собой атомы элементов-неметаллов. Возможно два
Сегодня мы будем рассматривать, как взаимодействуют между собой атомы элементов-неметаллов. Возможно два

Пусть «встречаются» два атома водорода. У каждого атома по одному электрону и, поэтому, самый лучший вариант для каждого атома эти электроны ОБЪЕДИНИТЬ, сделав их ОБЩИМИ.
При этом у каждого атома получается «заветная», двухэлектронная, очень устойчивая внешняя электронная оболочка.
Н· + ·Н → Н··Н - электронная формула
↑общая электронная пара
Если на приведённом рисунке заменить общую электронную пару на чёрточку-символ химической связи, то получается формула, которая называется структурная формула.
Н-Н - структурная формула
И последняя формула, показывающая, что молекула водорода состоит из двух атомов водорода, называется молекулярная формула.
Н2 – молекулярная формула
Слайд 3На прошлом уроке объяснялось, что образование любой ХИМИЧЕСКОЙ СВЯЗИ принято показывать с
На прошлом уроке объяснялось, что образование любой ХИМИЧЕСКОЙ СВЯЗИ принято показывать с

Так что сейчас мы рисовали схему образования ковалентной неполярной связи между атомами водорода. Самый короткий вариант изображения данной схемы, который мы будем использовать:
Н· + ·Н → Н··Н Н-Н Н2
↑общая структурная молекулярная
электронная пара формула формула
электронная формула
ХИМИЧЕСКУЮ СВЯЗЬ, возникающую в результате образования общих электронных пар, называют КОВАЛЕНТНОЙ (АТОМНОЙ) связью. Ковалентную связь между атомами одного химического элемента называют КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (К.Н.С.)
Для изображения подобных схем надо уметь показывать «непарные» (или «неспаренные») электроны, которые потом будут образовывать общие электронные пары.
Открываем ПСХЭ Д.И. Менделеева в вашем учебнике, находим 2 период, а в нём элементы-неметаллы С, N, О и F и определяем число электронов для каждого на внешнем энергетическом уровне.
Для С получается: 4 электрона Для N : 5 электронов
Для О : 6 электронов Для F : 7 электронов
Слайд 4Согласно правилу, приведённому в вашем параграфе, «число неспаренных» электронов вычисляется по формуле:
Согласно правилу, приведённому в вашем параграфе, «число неспаренных» электронов вычисляется по формуле:
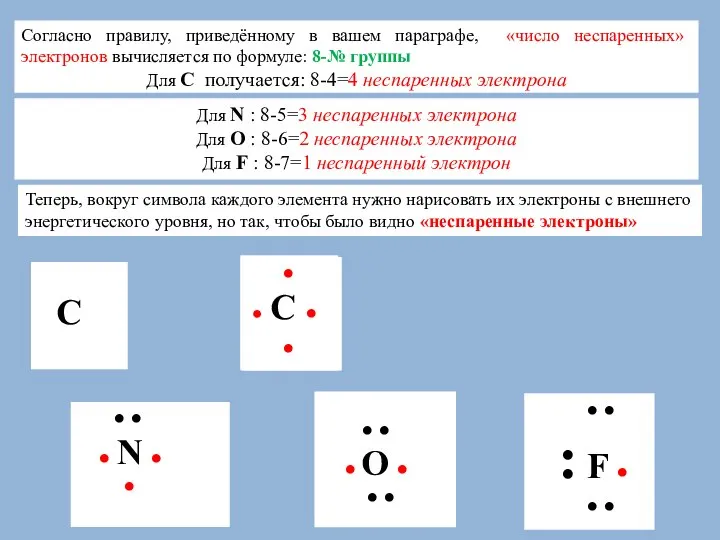
Для С получается: 8-4=4 неспаренных электрона
Теперь, вокруг символа каждого элемента нужно нарисовать их электроны с внешнего энергетического уровня, но так, чтобы было видно «неспаренные электроны»
Для N : 8-5=3 неспаренных электрона
Для О : 8-6=2 неспаренных электрона
Для F : 8-7=1 неспаренный электрон
● ●
● N ●
●
● ●
● О ●
● ●
● ●
: F ●
● ●
●
С
●
С
●
●
● С
●
●
● С ●
●
С
Слайд 5Теперь можно посмотреть как будут взаимодействовать атомы, у которых на внешнем энергетическом
Теперь можно посмотреть как будут взаимодействовать атомы, у которых на внешнем энергетическом
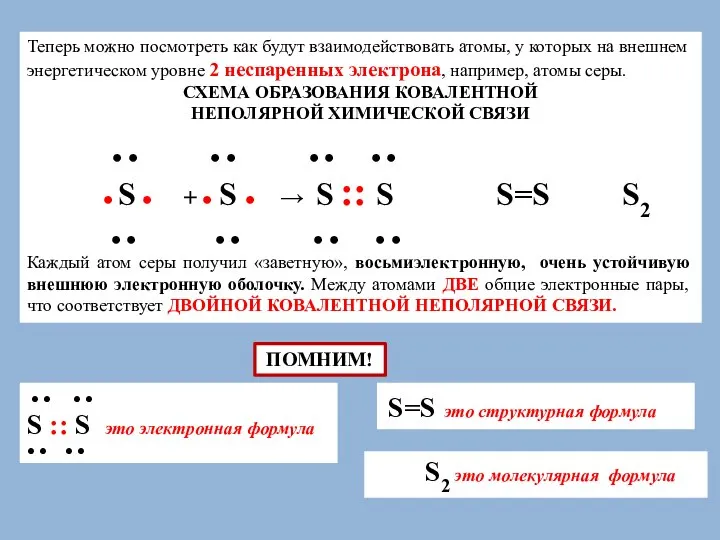
СХЕМА ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ
НЕПОЛЯРНОЙ ХИМИЧЕСКОЙ СВЯЗИ
● ● ● ● ● ● ● ●
● S ● + ● S ● → S :: S S=S S2
● ● ● ● ● ● ● ●
Каждый атом серы получил «заветную», восьмиэлектронную, очень устойчивую внешнюю электронную оболочку. Между атомами ДВЕ общие электронные пары, что соответствует ДВОЙНОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ СВЯЗИ.
● ● ● ●
S :: S это электронная формула
● ● ● ●
S=S это структурная формула
S2 это молекулярная формула
ПОМНИМ!
Слайд 6Теперь рассмотрим как будут взаимодействовать атомы, у которых на внешнем энергетическом уровне
Теперь рассмотрим как будут взаимодействовать атомы, у которых на внешнем энергетическом уровне

СХЕМА ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ
НЕПОЛЯРНОЙ ХИМИЧЕСКОЙ СВЯЗИ
● ● ● ● ● ● ● ●
● N ● + ● N ● → N N N≡N N2
● ●
Каждый атом азота получил «заветную», восьмиэлектронную, очень устойчивую внешнюю электронную оболочку. Между атомами ТРИ общие электронные пары, что соответствует ТРОЙНОЙ КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ СВЯЗИ.
● ● ● ●
N N это электронная формула
N≡N это структурная формула
N2 это молекулярная формула
Как вы знаете, электроны в атоме занимают атомные орбитали разной формы, например, s и p. При сближении атомов их атомные орбитали перекрываются. Для случая образования молекулы водорода это показано рисунком на стр. 68 вашего учебника. Значит, КОВАЛЕНТНАЯ СВЯЗЬ – это результат перекрывания атомных орбиталей.
ПОМНИМ!
 Рівноваги у розчинах електролітів
Рівноваги у розчинах електролітів Карбоновые кислоты
Карбоновые кислоты Структура к свойства веществ
Структура к свойства веществ Циклоалканы
Циклоалканы Получение бутандиола, как способ переработки природного газа
Получение бутандиола, как способ переработки природного газа Презентация на тему Мыло. Синтетические моющие средства
Презентация на тему Мыло. Синтетические моющие средства  Великие ученые общей и неорганической химии
Великие ученые общей и неорганической химии Алюминий и его соединения
Алюминий и его соединения Строение электронных оболочек атомов. Электроны в атоме
Строение электронных оболочек атомов. Электроны в атоме Номенклатура и изомерия алкенов
Номенклатура и изомерия алкенов Карбоновые кислоты
Карбоновые кислоты Презентация на тему Щавелевая кислота
Презентация на тему Щавелевая кислота  Строение атома. Распределение электронов
Строение атома. Распределение электронов Химическая кинетика
Химическая кинетика Парафины. Алканы
Парафины. Алканы Вирощування кристалів солей
Вирощування кристалів солей Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9
Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9 Простые эфиры и перекиси
Простые эфиры и перекиси Сахароза (С12Н22О11)
Сахароза (С12Н22О11) Сахар-рафинад
Сахар-рафинад Признаки химических реакций
Признаки химических реакций Химия. 8 класс. Подготовка к контрольной работе
Химия. 8 класс. Подготовка к контрольной работе «СберСтарЭнерго» «ЖИДКАЯ РЕЗИНА»
«СберСтарЭнерго» «ЖИДКАЯ РЕЗИНА» каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами
каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами Алкадиены. Закрепление пройденного материала
Алкадиены. Закрепление пройденного материала Плавленые сыры без фосфатов
Плавленые сыры без фосфатов Аналитические методы в современных исследованиях химии
Аналитические методы в современных исследованиях химии Оксиды и основания
Оксиды и основания