Слайд 2Введение
Цель: исследование физико-химических свойств щавелевой кислоты.
Задачи:
1. Подбор и освоение литературы по теме

курсовой работы
2. Изучение физико-химических свойств щавелевой кислоты
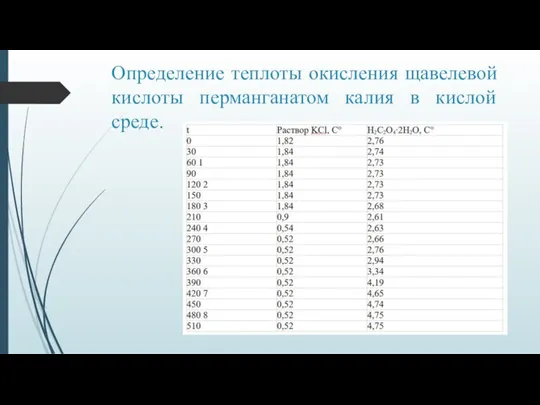
Слайд 3Определение теплоты окисления щавелевой кислоты перманганатом калия в кислой среде.
Слайд 4
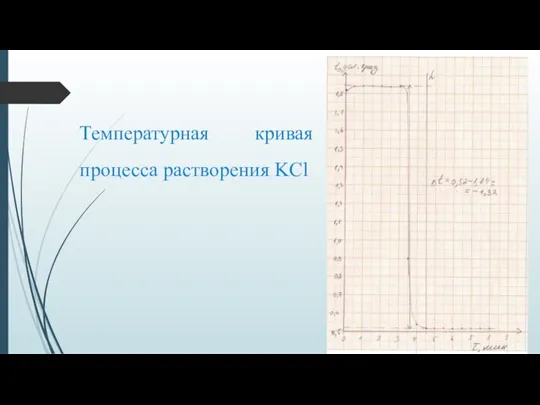
Температурная кривая процесса растворения KCl
Слайд 5Температурная кривая процесса растворения H2C2O4∙2H2O

Слайд 6На основе графика для процесса растворения KCl нашли:
Изменение температуры:
∆t = 0,52 —

1,84 = - 1,32 усл.град. (∆t < 0)
Теплоемкость калориметрической системы Скс:
Скс= ∆solHKCl / ∆t
∆solHKCl = 0,7067 + 3,01*10-3*(18,4-25) = 0,69 кДж
Cкс = -0,69/ - 1,32 = 0,52 кДж
На основе графика для процесса растворения H2C2O4∙2H2O нашли:
∆t1 = 4,65 — 2,79 = 1,86 усл.град
∆H = (M/m)*Ckc* ∆t1
M — молярная масса щавелевой кислоты (г/моль), m — масса окисленной щавелевой кислоты (г)
∆H = (90/0,18)*0,52*1,86 = 483,6 кДж
Слайд 7Определение степени электролитической диссоциации криоскопическим методом
Степень диссоциации: 0,55

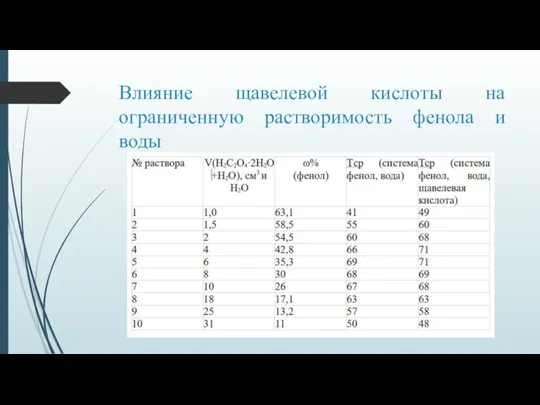
Слайд 8Влияние щавелевой кислоты на ограниченную растворимость фенола и воды
Слайд 9Диаграмма растворимости системы фенол-вода+H2C2O4∙2H2О и диаграмма растворимости системы фенол-вода
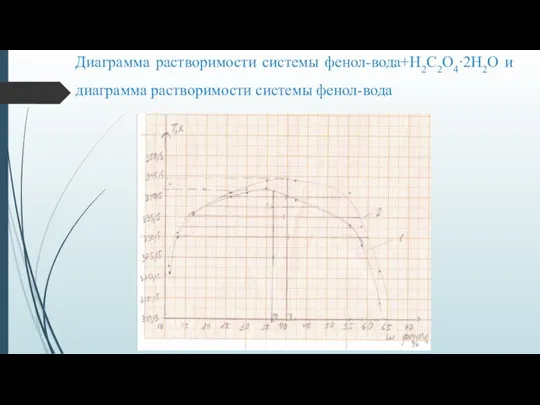
Слайд 10Определяем графически критическую температуру расслоения Tкр системы фенол – вода+ H2C2O4∙2H2О по

правилу Алексеева.
Tкр=344,15 К
Определяем состав системы, отвечающий Ткр
ωкр=40 %
Абсолютная ошибка: ∆Ткр = 4,75, ∆ωкр(Н2О) = 5,4
Относительная ошибка: 1,4% и 15,6% соответственно
Слайд 11Выводы
1) Исследовали физико-химические свойства щавелевой кислоты.
2) При определении теплоты окисления при комнатной

температуре получилась со знаком плюс, так как процесс является эндотермическим.
3) Криоскопический метод можно использовать для определения степени диссоциации электролита, так как ошибка измерений составила 20%. ?
4) В ходе исследования влияния щавелевой кислоты на ограниченную растворимость фенола и воды выяснили, что щавелевая кислота увеличивает площадь гетерогенной области, так как Ткр для системы фенол — раствор H2C2O4∙2H2О равна 344,15, а Ткр для фенол — вода — 341,15, и критический состав смещается в сторону содержания воды.










 Презентация на тему Полисахариды
Презентация на тему Полисахариды  Дисахариды и полисахариды
Дисахариды и полисахариды Предельные углеводороды - алканы
Предельные углеводороды - алканы Элемент первой группы, калий
Элемент первой группы, калий Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас
Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас Предмет химии, простые и сложные вещества
Предмет химии, простые и сложные вещества Значение химии в медицине
Значение химии в медицине Промышленный биокатализ
Промышленный биокатализ Контрольна робота, хімія
Контрольна робота, хімія Водород. История открытия
Водород. История открытия Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация  Оксиды
Оксиды Синтетические моющие средства (СМС). Наша стирка по-байкальски
Синтетические моющие средства (СМС). Наша стирка по-байкальски География. Уральские самоцветы
География. Уральские самоцветы Термохимия. Задания
Термохимия. Задания Čo sú chemické reakcie
Čo sú chemické reakcie Амины
Амины Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6
Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6 Металловедение
Металловедение Химическая термодинамика. Экзаменационные вопросы
Химическая термодинамика. Экзаменационные вопросы Серная кислота
Серная кислота Альдегиды и кетоны (часть 2)
Альдегиды и кетоны (часть 2) Галогеноалканы: получение, свойства и применение
Галогеноалканы: получение, свойства и применение Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Электроотрицательность (ЭО)
Электроотрицательность (ЭО) Чистячі засоби для ванної кімнати та кафелю
Чистячі засоби для ванної кімнати та кафелю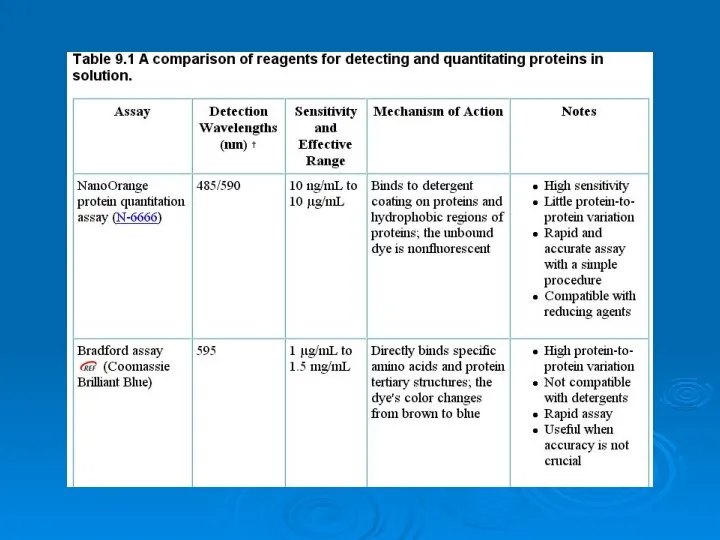 Analysis of proteins
Analysis of proteins Физические механизмы образования кристаллов
Физические механизмы образования кристаллов