Содержание
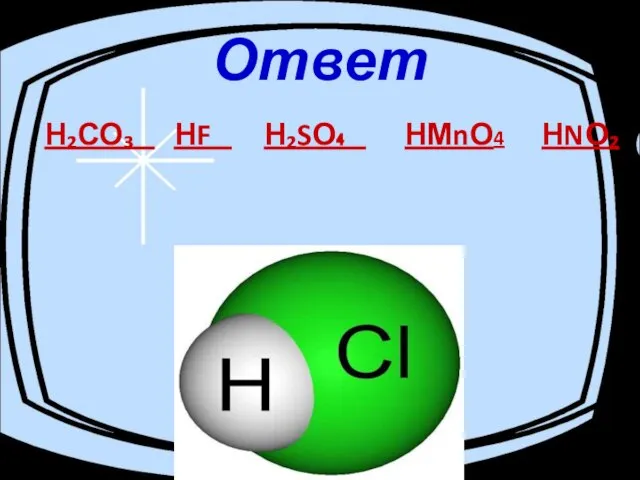
- 2. Ответ Н₂СО₃ НF Н₂SО₄ НМnО4 НNО₂
- 3. Кислоты в свете теории электролитической диссоциации (ТЭД)
- 4. Цели урока Вспомнить понятие о кислотах, как о классе электролитов; Рассмотреть классификацию кислот по различным признакам;
- 5. Задание № 1 I вариант 1)Используя содержание таблицы, дайте характеристику соляной (хлороводородной) кислоты. II вариант 1)Используя
- 6. Ответ I вариант (НСl) Бескислородная; Одноосновная; Растворимая; Летучая; Сильная; Стабильная; II вариант (Н₂CО₃) Кислородная; Двухосновная; Растворимая;
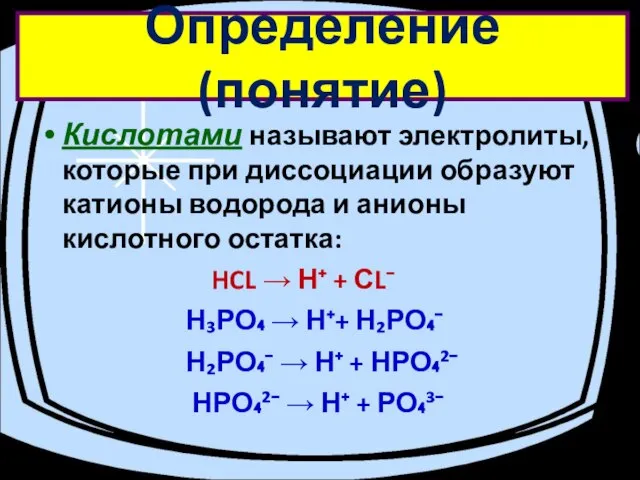
- 7. Определение (понятие) Кислотами называют электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка: HCL
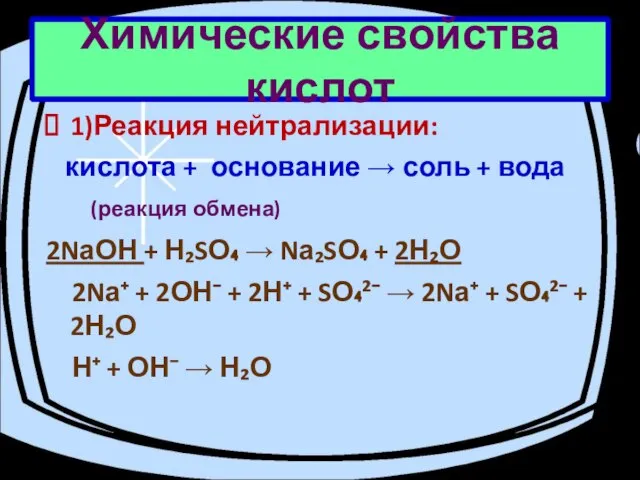
- 8. Химические свойства кислот 1)Реакция нейтрализации: кислота + основание → соль + вода (реакция обмена) 2NаОН +
- 9. 2)Взаимодействие кислот с оксидами металлов: кислота + оксид металла → соль + вода (реакция обмена) Fе₂О₃
- 10. 3)Взаимодействие кислот с металлами: кислота + металл → соль + водород (реакция замещения) Условия протекания реакций:
- 11. 3) Нерастворимые кислоты (кремневая) не вступают в реакции с металлами: Н₂SiО₃ + Мg → 4) Концентрированный
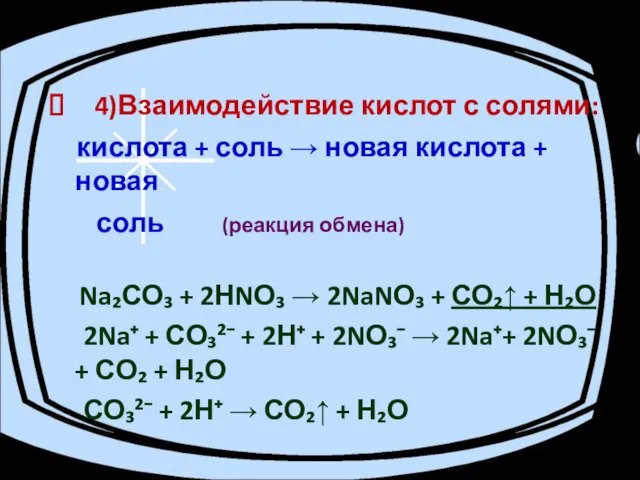
- 12. 4)Взаимодействие кислот с солями: кислота + соль → новая кислота + новая соль (реакция обмена) Na₂СО₃
- 13. Итоги 1. Классификация кислот; 2. Типичные химические свойства кислот; 3. Условия протекания типичных реакций кислот;
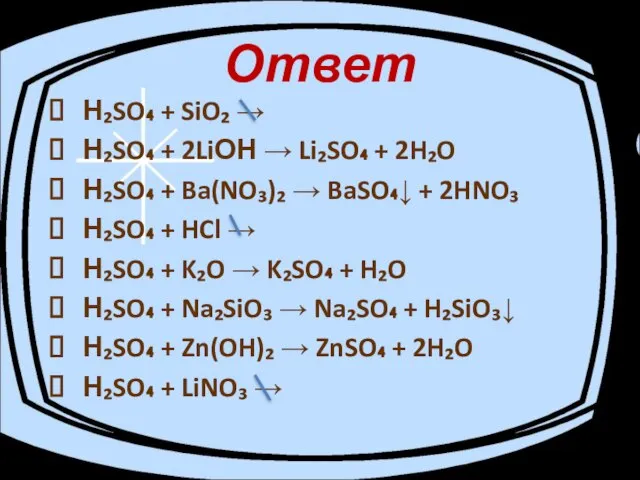
- 14. C какими из перечисленных веществ взаимодействует серная кислота. Составьте уравнения возможных реакции. SiO₂; LiOH; Ва(NO)₃; НСl;
- 15. Ответ Н₂SO₄ + SiO₂ → Н₂SO₄ + 2LiОН → Li₂SO₄ + 2H₂O Н₂SO₄ + Ba(NO₃)₂ →
- 16. Дополнительное задание Запишите молекулярные уравнения практически осуществимых реакций, протекающих между: магнием и соляной кислотой; оксидом бария
- 18. Скачать презентацию










 Расшифровка структуры гликозидов
Расшифровка структуры гликозидов Алкадиены. Каучук
Алкадиены. Каучук Ministry of Education and Science of the Russian Federation
Ministry of Education and Science of the Russian Federation Сплавы металлов
Сплавы металлов Природный газ
Природный газ Характеристика азота как химического элемента и простого вещества
Характеристика азота как химического элемента и простого вещества Химическая реакция в потоке в одномерном случае. Уравнение неразрывности
Химическая реакция в потоке в одномерном случае. Уравнение неразрывности lektsia_6 (1)
lektsia_6 (1) Алканы (строение и изомерия)
Алканы (строение и изомерия) Этапы приготовления и микроскопического исследования нативного препарата осадка мочи
Этапы приготовления и микроскопического исследования нативного препарата осадка мочи Исследование влияния изменения технических параметров на производительность установки замедленного коксования
Исследование влияния изменения технических параметров на производительность установки замедленного коксования 98675992
98675992 Вода как хладагент (R718)
Вода как хладагент (R718) Хроматография. Особенности метода хроматографии
Хроматография. Особенности метода хроматографии Пластмассы. Классификация
Пластмассы. Классификация Степени окисления и формулы веществ
Степени окисления и формулы веществ Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества
Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества Композиционные материалы. Основные закономерности
Композиционные материалы. Основные закономерности ОВР - метод полуреакции
ОВР - метод полуреакции Газообразные вещества и их применение
Газообразные вещества и их применение Серная кислота и её соли. Качественная реакция на сульфат-ион
Серная кислота и её соли. Качественная реакция на сульфат-ион Эфиры. 10 класс
Эфиры. 10 класс Век медный, бронзовый, железный
Век медный, бронзовый, железный Сульфаты (2)
Сульфаты (2) Гравиметрический анализ. Лекция 1
Гравиметрический анализ. Лекция 1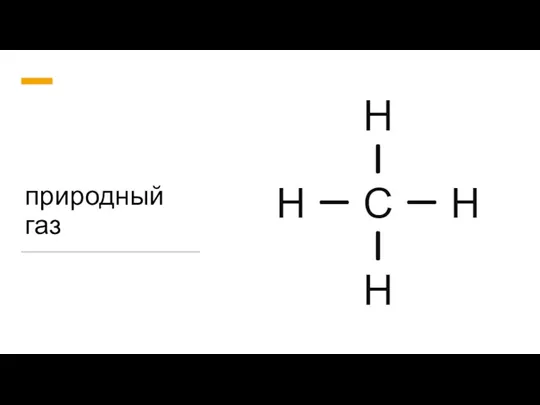 Природный газ
Природный газ Промышленное получение аминокислот и их применение в медицине и диетологии
Промышленное получение аминокислот и их применение в медицине и диетологии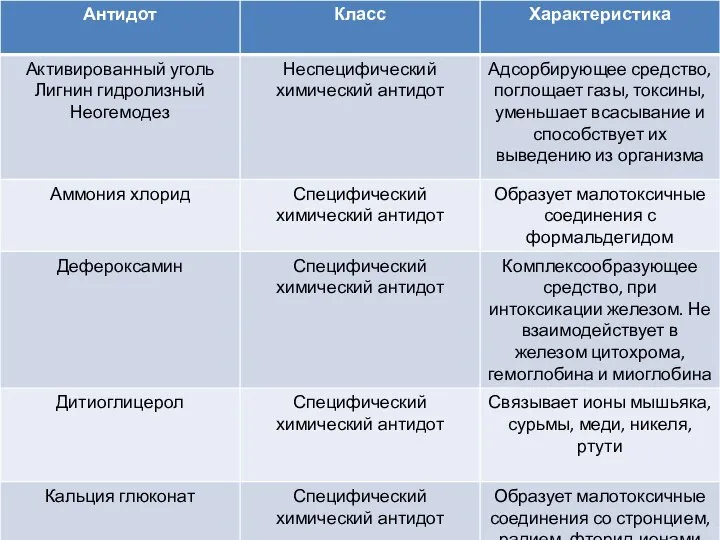 Антидоты. Класс. Характеристика
Антидоты. Класс. Характеристика