Слайд 2План изучения темы
1. Предпосылки открытия Периодического закона
2. Открытие Д.И. Менделеевым Периодического закона

3. Периодический закон и строение атома
4. Периодическая система и строение атома
5. Значение Периодического закона Д. И. Менделеева
Слайд 3Предпосылки открытия Периодического закона
1. Накопление фактологического материала
Ко времени открытия ПЗ было известно

63 химических элемента, описаны свойства их различных соединений.
Слайд 4По мере возрастания числа открытых химических элементов возникла необходимость их классификации и

систематизации. Первую попытку сделал еще в конце XVIII века А. Лавуазье, выделив 4 класса: газы и флюиды (свет и тепло), металлы, неметаллы, «земли» (оказавшиеся оксидами).
Антуан Лавуазье
Слайд 52. Работы предшественников Д.И. Менделеева:
- классификация Берцелиуса
Берцелиус разделил все элементы на металлы

и неметаллы, определил, что металлам соответствуют основные оксиды и основания, а неметаллам – кислотные оксиды и кислоты.
Слайд 6- триады Деберейнера
В 1817 году немецкий ученый И. Деберейнер располагает все известные

элементы отдельными триадами:
1) Li, Na, K;
2)Ca, Sr, Ba;
3) P, As, Sb;
4) S, Se, Te;
5) Cl, Br, J;
и обнаруживает интересную закономерность: масса атома среднего элемента равна среднеарифметическому из масс крайних элементов, например: ArNa = (Ar Li + Ar K)/2 = (6, 94 + 39,1)/2 = 23.
Слайд 7- октавы Ньюлендса
Известные в то время 62 элемента он расположил в порядке

возрастания их эквивалентов и подметил, что в этом ряду часто каждый 8-й как бы повторяет свойства каждого, условно считаемого за первый элемент.
H, Li, Be, B и т.д.; Na – девятый элемент повторяет свойства второго – Li, Ca – 17-ый повторяет свойства 10-го – Mg и т.д.
У него получилось 8 вертикальных столбцов
– октав.
Сходные элементы расположились
на горизонталях.
Выявленные закономерности он назвал
«законом октав».
Слайд 8- спираль Шанкуртуа
Шанкуртуа располагает 50 элементов по винтовой линии на поверхности цилиндра,

помещая их на линии, в соответствии с атомным весом.
Т.к. система заканчивалась теллуром, то эту систему назвали “теллуровый винт”.
Многие сходные элементы на цилиндре оказались друг под другом по вертикалям.
Это построение графически правильно выражало идею диалектического развития материи.
Слайд 9- кривая Мейера
Таблица Лотара Мейера основана на сходстве элементов по их валентности

по водороду.
Мейер подмечает, что разность между относительными атомными массами соседних по каждому столбцу элементов отличается на закономерно возрастающие числа: 16, 16, 45, 45, 90.
Он так же отмечает, что разность между Ar (Si) и Ar (Sn) ненормально велика (90 вместо 45).
Слайд 103. Участие Д.И. Менделеева в съезде химиков в Карлсруэ (1860 г.), где

утвердились идеи атомистики и понятие «атомный вес», которое сейчас известно под названием «относительная атомная масса».
4. Личностные качества Д.И. Менделеева.
Энциклопедичность знаний, научная интуиция, умение обобщать, постоянное стремление к познанию неведомого, дар научного предвидения Д.И. Менделеева.
Слайд 11Открытие Д.И. Менделеевым Периодического закона
Систематикой химических элементов Д.И.Менделеев стал заниматься в самом

начале своей научной деятельности.
В 1855-1856 годах он опубликовал 2 работы по исследованию изоморфизма и удельных объемов и установил зависимость между этими характеристиками и свойствами.
Он также внимательно изучал работы предшественников, подверг их критическому анализу
Сопоставление разных групп элементов по
их атомным массам привело к открытию
закона в форме составления
«Опыта системы элементов»,
четко выявившего периодическую
зависимость свойств элементов
от их атомных масс.
Слайд 126 марта 1869 года на заседании Русского Химического общества Меншуткин от имени

Д.И.Менделеева сделал сообщение о соотношении свойств и атомных масс элементов.
В течение двух последующих лет Менделеев составляет таблицы атомных объемов элементов, которые тоже изменяются периодически. Позднее убеждается, что высшая валентность элементов также периодическая функция.
Эти открытия позволили от «Опыта периодической системы» перейти к «естественной системе элементов».
Слайд 13Первоначальный вариант Периодической системы, воспроизведенный на здании в Санкт-Петербурге, где работал Д.

И. Менделеев
Слайд 15В основу своей работы Менделеев положил 2 основных признака – величину массы

атома (относительной атомной массы элемента) и свойства элемента.
Менделеев расположил все ему известные химические элементы в единую цепочку по возрастанию относительной атомной массы и отметил в ней отрезки – периоды, в которых свойства элементов и образованных ими веществ изменялись сходным образом, а именно:
1) металлические свойства ослабевали;
2) неметаллические свойства усиливались;
Слайд 163) степень окисления элементов в высших оксидах увеличивалась с +1 до +7;
4)

степень окисления элементов в гидридах, в водородных соединениях металлов, возрастала с +1 до + 3, а затем возрастала в летучих водородных соединениях с -4 до-1;
5) оксиды от основных через амфотерные сменялись кислотными;
6) гидроксиды от щелочей через амфотерные сменялись кислотами.
Слайд 17
Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от

величины масс их атомов.
Современная формулировка:
свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядер их атомов.
Слайд 18Периодический закон и строение атома
Формулировка ПЗ не была точной и полной с

современной точки зрения, т.к. она отражала состояние науки на тот период времени, когда не было известно ничего о сложности строения атома.
Впервые физический смысл порядкового номера раскрыл голландский учёный Ван-ден-Брук, который теоретически доказал, что порядковый номер химического элемента равен заряду ядра его атома. Гипотеза была экспериментально подтверждена англичанином Мозли.
Ван-ден-Брук Генри Мозли
Слайд 19Символика Периодической системы Д.И. Менделеева
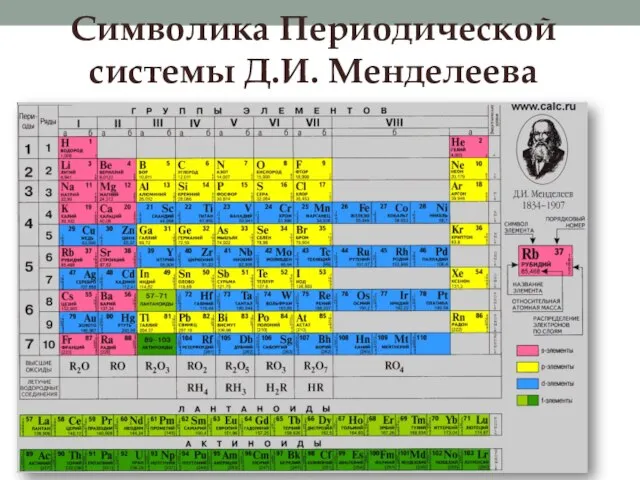
Слайд 20Периодическая система и строение атома
Периодическая система химических элементов – это графическое отображение

ПЗ.
Каждое обозначение в Периодической системе отражает какую-либо особенность или закономерность в строении атомов элементов:
Порядковый номер – заряд ядра, число протонов, число электронов.
Номер периода – число энергетических уровней в атомах химических элементов данного периода.
Номер группы – число электронов на внешнем уровне для элементов главных подгрупп и максимальное число электронов для элементов побочных подгрупп.



















 Лекарственные средства – производные пиримидина
Лекарственные средства – производные пиримидина Дисахариды и полисахариды
Дисахариды и полисахариды Окислительно-восстановительные реакции. Лекция №7
Окислительно-восстановительные реакции. Лекция №7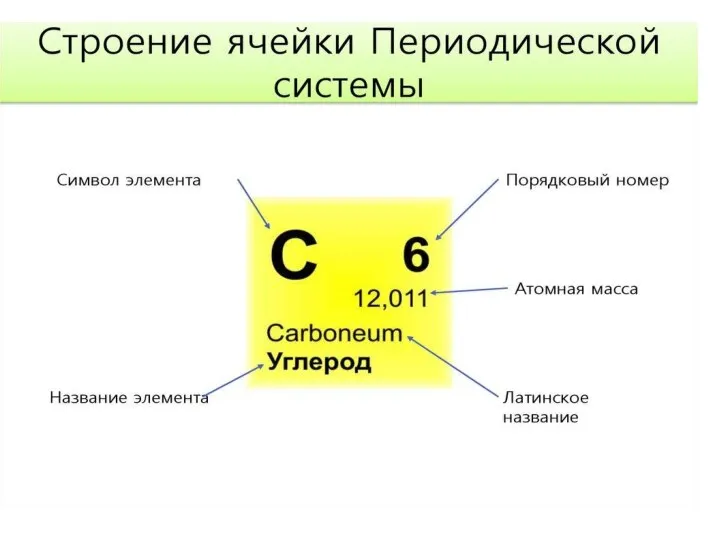 Строение ячейки периодической системы Менделеева
Строение ячейки периодической системы Менделеева Определение содержание фосфатов в воде фотометрическим методом
Определение содержание фосфатов в воде фотометрическим методом Метилэтилкетон. Его применение и процесс получения
Метилэтилкетон. Его применение и процесс получения Скорость химической реакции и химическое равновесие. Задание 20 в ЕГЭ
Скорость химической реакции и химическое равновесие. Задание 20 в ЕГЭ Reactivi444
Reactivi444 Празеодим
Празеодим Скорость химической реакции. Химическое равновесие
Скорость химической реакции. Химическое равновесие Спирты и фенолы. (Лекция 6.1)
Спирты и фенолы. (Лекция 6.1) Образование первичной структуры белка
Образование первичной структуры белка Валентные возможности атомов элементов
Валентные возможности атомов элементов Строение атома
Строение атома Презентация на тему Круговорот углерода в природе
Презентация на тему Круговорот углерода в природе  4.1-2 Генетическая связь+
4.1-2 Генетическая связь+ Физические свойства воды.Перегонка. Растворимость веществ в воде
Физические свойства воды.Перегонка. Растворимость веществ в воде Адсорбция. Адсорбент
Адсорбция. Адсорбент Cеминар 6 -Алканы-2
Cеминар 6 -Алканы-2 Изотермический распад переохлажденного аустенита. Экспериментальная часть
Изотермический распад переохлажденного аустенита. Экспериментальная часть Презентация на тему Великие химики
Презентация на тему Великие химики  Альдегиды. Кетоны
Альдегиды. Кетоны Химическое равновесие и способы его смещения. Принцип Ле Шателье. 9 класс
Химическое равновесие и способы его смещения. Принцип Ле Шателье. 9 класс Проект Волшебство химии
Проект Волшебство химии Кислород и водород
Кислород и водород Әртүрлі заттардың кристаллдық тор энергиясын, сольваттану энергиясын, гидратация жылуын есептеу
Әртүрлі заттардың кристаллдық тор энергиясын, сольваттану энергиясын, гидратация жылуын есептеу Презентация на тему Спирты
Презентация на тему Спирты  Сплавы на основе меди, титана, никеля
Сплавы на основе меди, титана, никеля