Слайд 2Положение в периодической таблице.
Строение атома
В периодической системе находятся в главной подгруппе

II группы.
Являются сильными восстановителями, отдают 2 ē, во всех
соединениях проявляют степень окисления +2.
Mg +12 2ē, 8ē, 2ē
Ca +20 2ē, 8ē, 8 ē, 2ē
Sr +38 2ē, 8ē, 18 ē, 8ē, 2ē
Ba +56 2ē, 8ē, 18 ē, 18 ē, 8ē, 2ē
Слайд 3Физические свойства
цвет пламени þ t плавления
1,74г/см3 651 С0
1,54г/см3
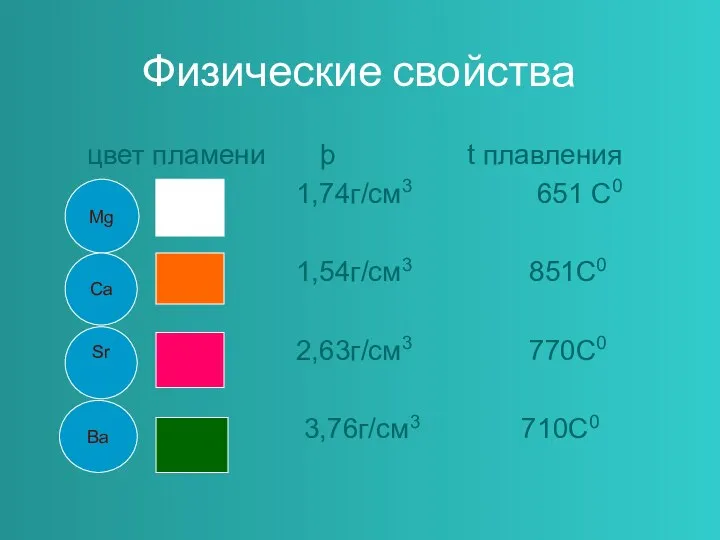
851С0
2,63г/см3 770С0
3,76г/см3 710С0
Mg
Ca
Sr
Ba
Слайд 4Химические свойства
2Me0 +O2 → 2Me+2O-2
Me0 +H2 → Me+2H2
Me0 +Cl02 → Me+2Cl2
Me0 +S0
→ Me+2S-2
Me0 +2HCl → Me+2Cl2 + H2
Me0 +2HOH → Me+2(OH)2 +Н2
Слайд 5Открытие щелочноземельных
металлов
Стр. 105

Слайд 6Соединения щелочноземельных
металлов
Стр. 99-103
Слайд 7Соединения щелочноземельных
металлов
Оксиды щелочноземельных металлов легко реагируют с оксидами неметаллов с образованием

соответствующих солей.
Слайд 8BaSO4
Благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике –
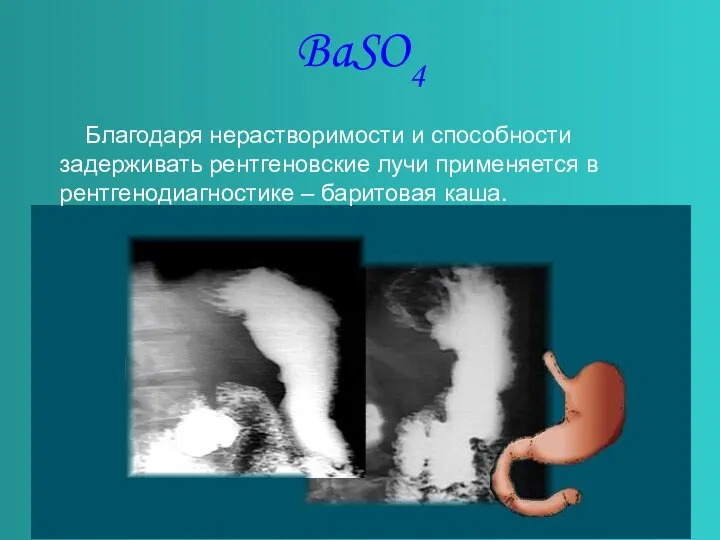
баритовая каша.
Слайд 9Ca3(PO4)2
Входит в состав фосфоритов и апатитов, а также в состав
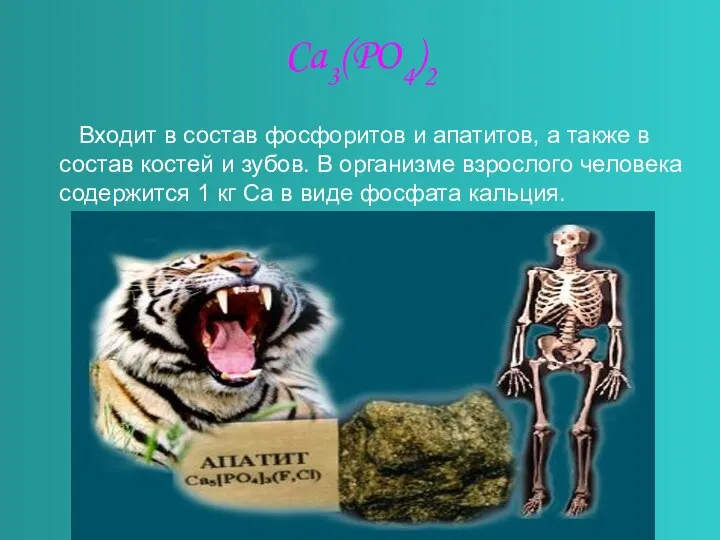
костей и зубов. В организме взрослого человека содержится 1 кг Са в виде фосфата кальция.
Слайд 10CaCO3
Карбонат кальция – одно из самых распространённых на Земле соединений. Его

содержат горные породы – мел, мрамор, известняк.
Слайд 11CaSO4∙ 2H2O
Встречается в природе в виде минерала гипса, представляющего собой

кристаллогидрат. Используется в строительстве, в медицине для наложения гипсовых повязок, для получения слепков.
Слайд 12MgCO3
Широко применяется в производстве стекла, цемента, кирпича, а также в металлургии

для перевода пустой породы в шлак.
Слайд 13Са(ОН)2
Гидроксид кальция или гашёная известь с песком и водой называется известковым

раствором и широко используется в строительстве. При нагревании разлагается на оксид и воду.












 Бензилиденкетоны в синтезе замещённых бензимидазолопиримидинов
Бензилиденкетоны в синтезе замещённых бензимидазолопиримидинов Амины. Способы получения
Амины. Способы получения Металлы. Контрольная работа
Металлы. Контрольная работа Решение задач на нахождение молекулярной формулы газообразного алкана
Решение задач на нахождение молекулярной формулы газообразного алкана Презентация по Химии "Фосфор - элемент жизни и мысли"
Презентация по Химии "Фосфор - элемент жизни и мысли"  Строение вещества. Химическая связь
Строение вещества. Химическая связь Селективность (реакторы)
Селективность (реакторы) Алкены
Алкены Циклоалканы (полиметиленовые, циклопарафины, ациклические)
Циклоалканы (полиметиленовые, циклопарафины, ациклические) Строение вещества
Строение вещества Мыла и синтетические
Мыла и синтетические Сeквенирование нуклеиновых кислот
Сeквенирование нуклеиновых кислот Многообразие веществ
Многообразие веществ Алкены. Роль алкенов в жизни человека
Алкены. Роль алкенов в жизни человека Типичные окислители. 9 класс
Типичные окислители. 9 класс Презентация на тему Химические реакции 11 класс
Презентация на тему Химические реакции 11 класс  Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Опыт Пилатра де Розьера
Опыт Пилатра де Розьера Очистка различных поверхностей от нефтяных загрязнений
Очистка различных поверхностей от нефтяных загрязнений Алмаз. Свойства алмазов
Алмаз. Свойства алмазов Ковалентная неполярная связь
Ковалентная неполярная связь Валентность химических элементов
Валентность химических элементов минералы_4_блеск
минералы_4_блеск Электролиз растворов и расплавов неорганических и органических электролитов
Электролиз растворов и расплавов неорганических и органических электролитов Перекрывающиеся гены
Перекрывающиеся гены Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4
Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4 Структурный тип
Структурный тип Кислородсодержащие органические соединения
Кислородсодержащие органические соединения