Слайд 2ПЛАН:
→ Что такое биологические катализаторы?
→ Как действуют ферменты в живых системах?
→ Классификация

ферментов.
→ Какие факторы влияют на активность биологических катализаторов?
→ Какие вещества называются коферментами?
→ Кинетика ферментативного катализа. Уравнение Михаэлиса-Ментена.
→ Биологическая роль ферментативного катализа.
Слайд 3
Биологические катализаторы
Катализаторы биологические, биокатализаторы, вещества, образующиеся в живых клетках и ускоряющие

(положительный катализ) или замедляющие (отрицательный катализ) химические процессы, протекающие в организмах.
К их числу относятся в первую очередь катализаторы белковой природы, называемые энзимами, или ферментами.
Наука о ферментах называется энзимологией.
Слайд 4Ферменты как биологические катализаторы обладают всеми общими свойствами обычных катализаторов.
Общие свойства

катализаторов:
→ сами не вызывают химическую реакцию, а только ускоряют реакцию, которая протекает и без них;
→ не влияют на энергетический итог реакции; → в обратимых реакциях ускоряют как прямую, так и обратную реакцию, причем в одинаковой степени.
Слайд 5Действие ферментов в живых системах
Действие ферментов зависит от ряда факторов:
→От температуры (max

40-50°С);
→ Активной реакции среды – pH (кислотность);
→ От присутствия специфических активаторов и неспецифических или специфических ингибиторов.
Слайд 6Специфичность и механизм действия ферментов
Действие ферментов, строго специфично и зависит от строения

субстрата, на который фермент действует. Прекрасным примером такой зависимости служит катализируемая аргиназой реакция гидролитического расщепления аминокислоты аргинина на орнитин и мочевину:
Слайд 8Факторы,влияющие на активность биологических катализаторов:
→Влияние температуры;
→ Влияние рН среды;
→ Влияние концентрации фермента

и субстрата;
→ Влияние веществ-регуляторов;
→ Конкурентное ингибирование;
→ Неконкурентное ингибирование;
→ Аллосторическая регуляция активности ферментов.
Слайд 9Коферменты, или коэнзимы — малые молекулы небелковой природы, специфически соединяющиеся с соответствующими белками, называемыми апоферментами, и играющие роль активного

центра или простетической группы молекулы фермента.
Комплекс кофермента и апофермента образует целостную, биологически активную молекулу фермента, называемую холоферментом.
Слайд 10Роль коферментов нередко играют витамины или их метаболиты
(чаще всего — фосфорилированные формы витаминов группы

B).
Например, коферментом фермента карбоксилазы является
тиаминпирофосфат, коферментом многих аминотрансфераз — пиридоксаль-6-фосфат.
Коферменты, как правило, термостабильны, разнообразны по химическому строению и механизму действия.
Наиболее распространенную группу составляют соединения нуклеотидной природы, а также К., содержащие остатки фосфорной кислоты.
Слайд 11Кинетика ферментативного катализа
Учение о скоростях. Любая химическая реакция характеризуется, кроме принципиальной возможности

ее протекания (обусловленной законами термодинамики), скоростью процесса. Скорость ферментативной реакции - изменение [S] или [P] в единицу времени. Измерив ее скорость, то есть скорость в присутствии фермента, мы должны измерить скорость реакции и в отсутствии фермента (спонтанно протекающая реакция). Именно эта разность и характеризует работу фермента.
Измеряя скорость реакции, всегда надо измерять начальную скорость процесса, то есть скорость ферментативной реакции, в достаточно короткий промежуток времени, когда концентрация субстрата меняется, не настолько значительно, чтобы это отразилось на скорости процесса. Единицы измерения скорости реакции могут быть разными. Лучше пользоваться молярными единицами, а время - это минуты или секунды, реже часы. Поэтому скорость реакции может выражаться, например, в мкмоль/мин или ммоль/час. Величина скорости определяется законом действующих масс. В общем случае скорость химической реакции пропорциональна произведению концентрации реагирующих веществ. В случае ферментативной кинетики - одно из реагирующих веществ - фермент, концентрация которого на много порядков МЕНЬШЕ, чем концентрация субстрата. Это определяет некоторые особенности кинетики ферментативного катализа.
V = k+2. [E].[S]
Слайд 12 Уравнение Михаэлиса-Ментена:
Где k3 и Кт – константы, характерные для каждой реакции,
S- концентрация субстрата.
Эта

зависимость, установленная экспериментально для многих ферментативных реакций, может быть теоретически выведена, если превращение субстрата в продукт реакции (Р) происходит по механизму образования и распада комплекса между ферментом и субстратом – ES-комплекса:
Слайд 13→ Важную роль в ферментативном катализе играет аллостерическая регуляция. Изучение тонких механизмов
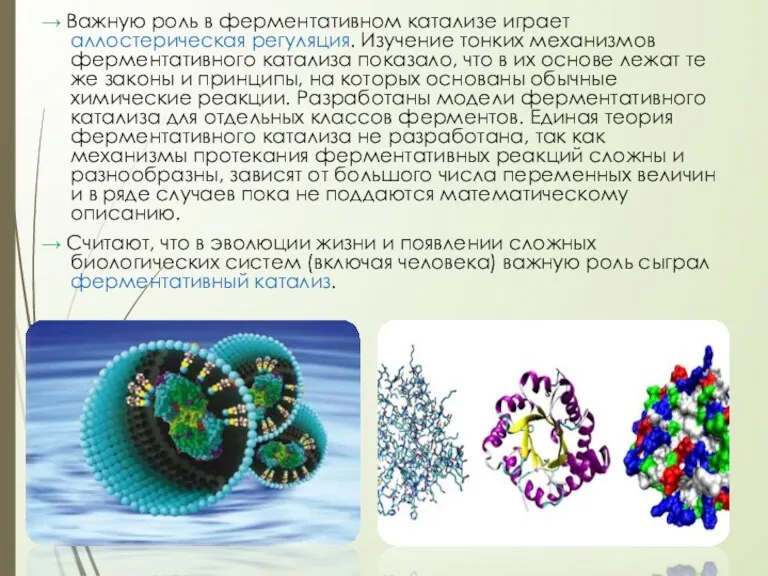
ферментативного катализа показало, что в их основе лежат те же законы и принципы, на которых основаны обычные химические реакции. Разработаны модели ферментативного катализа для отдельных классов ферментов. Единая теория ферментативного катализа не разработана, так как механизмы протекания ферментативных реакций сложны и разнообразны, зависят от большого числа переменных величин и в ряде случаев пока не поддаются математическому описанию.
→ Считают, что в эволюции жизни и появлении сложных биологических систем (включая человека) важную роль сыграл ферментативный катализ.
Слайд 14Применение ферментов
Ферментативные процессы являются основой многих производств: хлебопечения, виноделия, пивоварения, сыроделия, производства

спирта, чая, уксуса.
Слайд 15Каталаза широко применяется в пищевой и резиновой промышленности, а расщепляющие полисахариды целлюлазы

и пектидазы — для осветления фруктовых соков.
Слайд 16С помощью ферментов получают лекарственные препараты и сложные химические соединения.

Слайд 17История изучения
Термин «фермент» был предложен в XVII веке химиком ван Гельмонтом при

обсуждении механизмов пищеварения.
В 1833 французскими химиками А. Пайеном и Ж. Персо впервые из прорастающих зерен ячменя было выделено активное вещество, осуществляющее превращение крахмала в сахар и получившее название диастазы(амилазы).
Слайд 18В середине 19 в. разгорелась дискуссия о природе брожения. Пастер считал, что

брожение вызывается лишь живыми микроорганизмами и что процесс брожения неразрывно связан с их жизнедеятельностью. А Либих и его сторонники, отстаивая химическую природу брожения, считали, что оно является следствием образования в клетках микроорганизмов растворимых ферментов.
Луи Пастер Юстас Либих Марселен Бертло Клод Бернар
Слайд 19Дискуссия Либиха и Пастера о природе брожения была разрешена в 1897 Э.Бухнером,

который, растирая дрожжи с инфузорной землёй, выделил из них бесклеточный растворимый ферментный препарат (зимазу), вызывавший спиртовое брожение.
Открытие Бухнера утвердило материалистическое понимание природы брожений.
Слайд 20Функции ферментов
Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих

в живых организмах — ими катализируется около 4000 биореакций.
Ферменты играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма.


















 Подгруппа кислорода. Решение экспериментальных задач
Подгруппа кислорода. Решение экспериментальных задач Синтетические материалы
Синтетические материалы Химия и производство
Химия и производство Реакция полимеризации
Реакция полимеризации Презентация на тему Нанохимия
Презентация на тему Нанохимия  Жизнь и деятельность Д.И.Менделеева «Если не будешь знать имен, то умрет и познание вещей» К.Линей. Автор: Ватитова А.А. МОУ Еласов
Жизнь и деятельность Д.И.Менделеева «Если не будешь знать имен, то умрет и познание вещей» К.Линей. Автор: Ватитова А.А. МОУ Еласов Алкены
Алкены Сплавы цветных металлов
Сплавы цветных металлов Сера. Аллотропия серы. Физические и химические свойства серы. Применение
Сера. Аллотропия серы. Физические и химические свойства серы. Применение Минерал дунит
Минерал дунит Альдегиды, их химические и физические свойства. Получение и применение альдегидов
Альдегиды, их химические и физические свойства. Получение и применение альдегидов Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи
Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи Спирты (10 класс)
Спирты (10 класс) Сера и её соединения
Сера и её соединения Homecredit Bank. Показатели и зоны роста
Homecredit Bank. Показатели и зоны роста Атомы. Нахождение в природе
Атомы. Нахождение в природе Угольная кислота и её соли
Угольная кислота и её соли Ионные уравнения
Ионные уравнения Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона
Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона Введение в биохимию. Строение и свойства белков
Введение в биохимию. Строение и свойства белков Область применения карбоновых кислот
Область применения карбоновых кислот Полимеры и пластмассы
Полимеры и пластмассы Строение атома. Распределение электронов
Строение атома. Распределение электронов Лакокрасочные материалы
Лакокрасочные материалы Презентация на тему Cкорость химических реакций
Презентация на тему Cкорость химических реакций  Соли азотной кислоты
Соли азотной кислоты Кислород и сера
Кислород и сера Анилин. Строение и свойства анилина
Анилин. Строение и свойства анилина