Содержание
- 2. Карбоновые кислоты – это производные УВ, содержащие функциональную группу –карбоксил -COOH Карбоксильная группа состоит из карбонильной
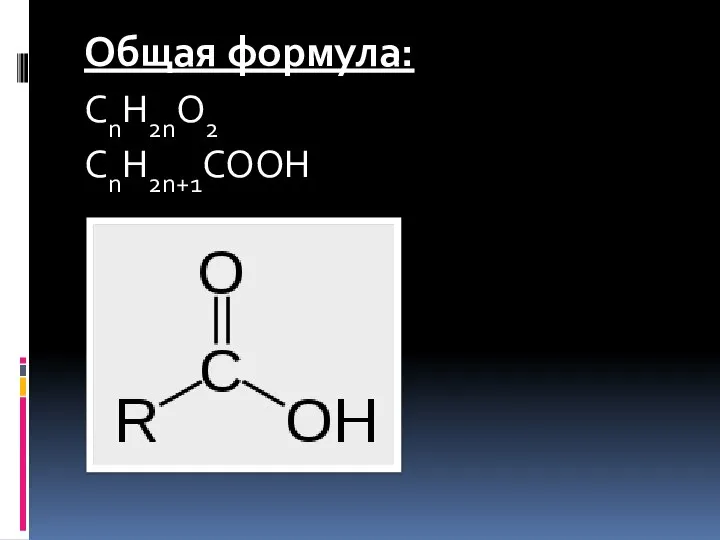
- 3. Общая формула: CnH2nO2 CnH2n+1COOH
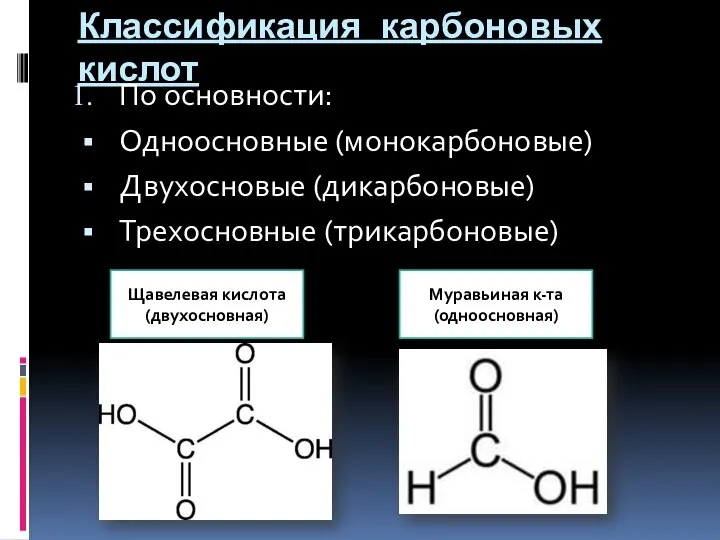
- 4. Классификация карбоновых кислот По основности: Одноосновные (монокарбоновые) Двухосновые (дикарбоновые) Трехосновные (трикарбоновые) Щавелевая кислота (двухосновная) Муравьиная к-та
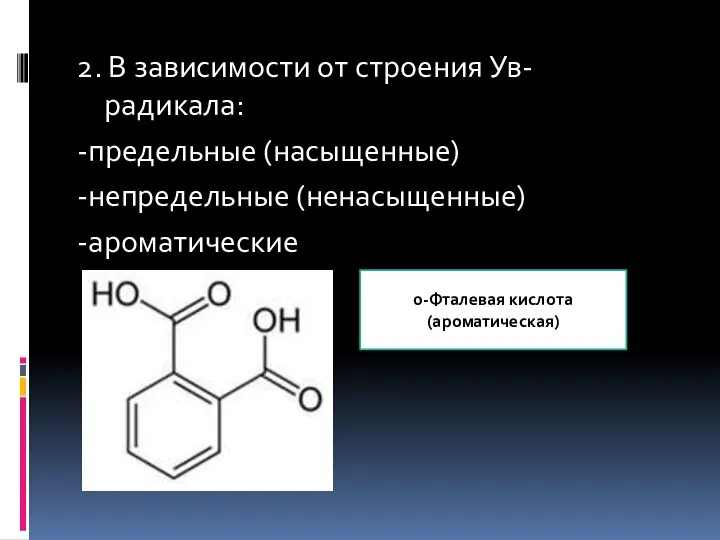
- 5. 2. В зависимости от строения Ув-радикала: -предельные (насыщенные) -непредельные (ненасыщенные) -ароматические 0-Фталевая кислота (ароматическая)
- 6. Номенклатура и изомерия Распространены тривиальные названия. По правилам IUPAC добавляют к названию соответствующего УВ окончание –овая
- 7. Изомерия: 1.Углеродной цепи, н-р у формулы С4Н9СООН изомеры: 2. Межклассовая изомерия сложным эфирам:
- 8. Электронное строение Электронная плотность Н в гидроксогруппе втягивается в п-систему карбонильной группы. За счет чего увеличивается
- 9. Физические свойства От СН2О2 по С9Н19СООН – жидкости От С10Н21СООН… - твердые вещества От низших кислот
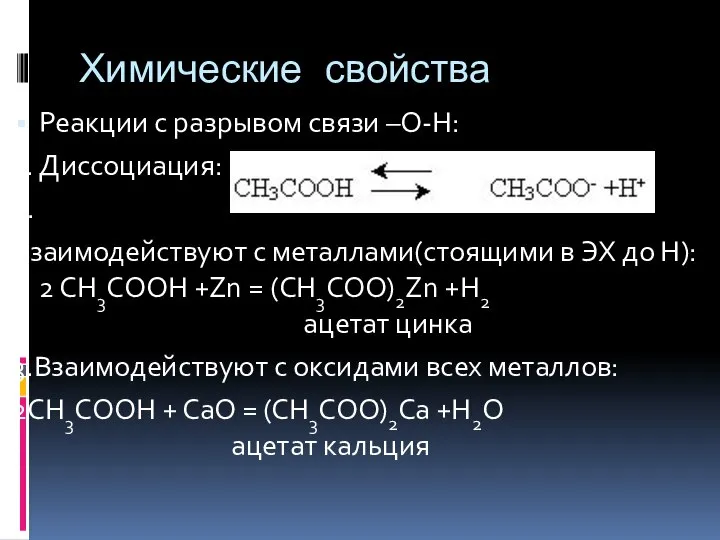
- 10. Химические свойства Реакции с разрывом связи –О-Н: 1. Диссоциация: 2. Взаимодействуют с металлами(стоящими в ЭХ до
- 11. 4. Взаимодействуют с растворимыми и нерастворимыми основаниями: СН3СООН +NaOH = СН3СООNa +Н2О ацетат натрия 2СН3СООН +
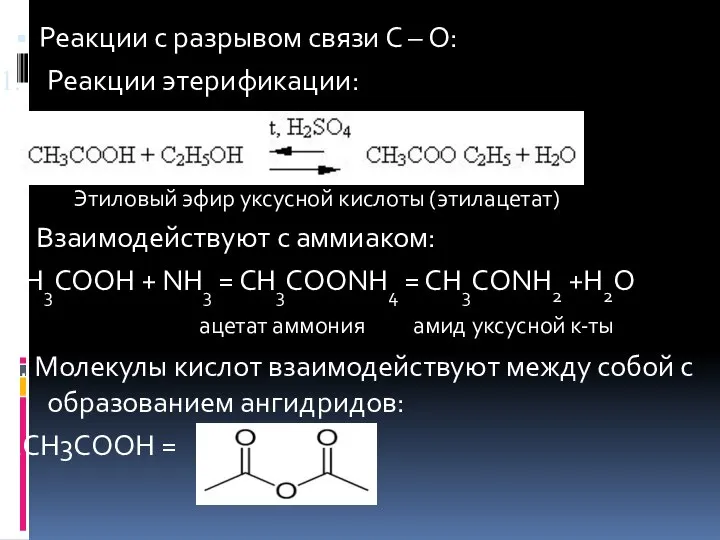
- 12. Реакции с разрывом связи С – О: Реакции этерификации: Этиловый эфир уксусной кислоты (этилацетат) 2. Взаимодействуют
- 13. Реакции в УВ-радикале: Галогенирование:
- 14. Получение карбоновых кислот Окисление первичных спиртов и альдегидов: 5CH3-CHO + 2KMnO4 +3H2SO4 → 5CH3-COOH + K2SO4
- 15. Специфические способы получения: Щелочной гидролиз(необратима!) R-COOR1+NaOH=R-COONa+R1OH R-COONa+HCl=R-COOH+NaCl Муравьиной кислоты: NaOH+CO=HC-COONa HC-COONa+HCl=HC-COOH+NaCl 2. Декарбоксилирование щавелевой к-ты: HOOC-COOH=HCOOH+CO2
- 16. Уксусной кислоты: Для пищевых целей (под действием ферментов): С2H5OH+O2=CH3COOH+H2O 2. В промышленности: А) окислением бутана Б)
- 17. Муравьиная кислота и особенности ее свойств Сочетает в себе карбонильную и карбоксильную группу. Характерны функции альдегидов
- 18. Особенности химических свойств: Взаимодействует со свежеприготовленным гидроксидом меди (II): HCOOH+Cu(OH)2 = Cu2O+CO2+H2O Взаимодействует с аммиачным раствором
- 19. Вопросы к теме: Дайте определение карбоновых кислот, расскажите об электронном строении. Какая из двух кислот: уксусная
- 21. Скачать презентацию













 Теория электролитической диссоциации. Контрольный тест
Теория электролитической диссоциации. Контрольный тест Презентация на тему Химический состав клетки: ультрамикроэлементы
Презентация на тему Химический состав клетки: ультрамикроэлементы  Химики на службе у дорог
Химики на службе у дорог Презентация на тему Алканы (10 класс)
Презентация на тему Алканы (10 класс)  Основные понятия химической кинетики. Скорость химической реакции
Основные понятия химической кинетики. Скорость химической реакции Внеклассное мероприятие по химии для учащихся 8 классов
Внеклассное мероприятие по химии для учащихся 8 классов Основные виды сырья для промышленности органического и нефтехимического синтеза
Основные виды сырья для промышленности органического и нефтехимического синтеза Устойчивое развитие
Устойчивое развитие Задачи. Химические элементы
Задачи. Химические элементы Металлы и их соединения
Металлы и их соединения Образование раствора
Образование раствора Нуклеиновые кислоты (НК)
Нуклеиновые кислоты (НК) Виды гибридизации атома углерода
Виды гибридизации атома углерода Полупроводники. Химические свойства полупроводников
Полупроводники. Химические свойства полупроводников Электронное и пространственное строение алкенов. Гомология и изомерия алкенов
Электронное и пространственное строение алкенов. Гомология и изомерия алкенов Презентация на тему Спирты (10 класс)
Презентация на тему Спирты (10 класс)  Альдегиды и кетоны (часть 2)
Альдегиды и кетоны (часть 2) Презентация на тему Кальций
Презентация на тему Кальций  Минералы алюминия
Минералы алюминия Углеводы (Сахариды)
Углеводы (Сахариды) Решение расчетных задач по уравнениям реакций
Решение расчетных задач по уравнениям реакций ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ
ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы
Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы Алкины
Алкины Спирт. Виды спиртов
Спирт. Виды спиртов Водные растворы электролитов
Водные растворы электролитов Кремний. Физический свойства. Получение. Применение
Кремний. Физический свойства. Получение. Применение Электролиз расплавов растворов
Электролиз расплавов растворов