Содержание
- 2. Азот – Элемент главной подгруппы пятой группы второго периода периодической системы химических элементов Д. И. Менделеева
- 3. Степени окисления
- 4. Химические свойства С металлами Без нагрева: 6Li + N2 = 2Li3N2 С нагревом: 3Mg + N2
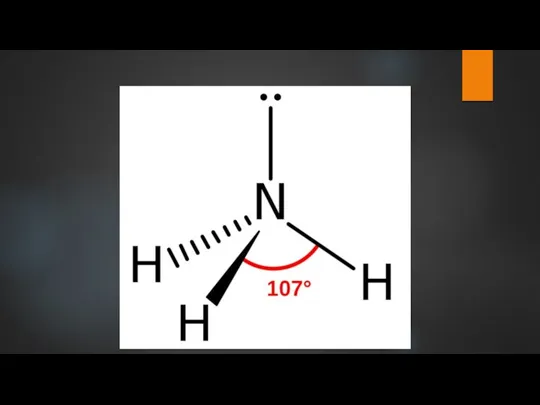
- 5. Аммиак
- 8. Физические свойства аммиака Бесцветный газ с резким запахом, почти в два раза легче воздуха. Ядовит, поэтому
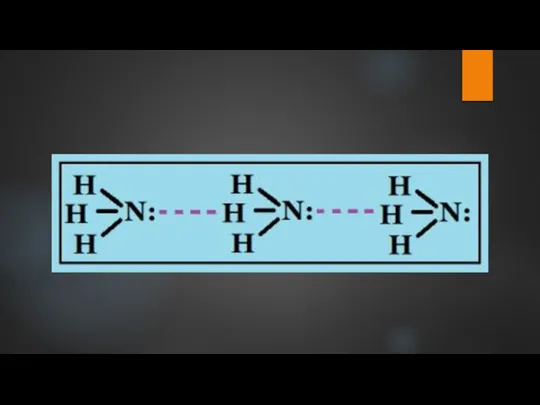
- 9. Химические свойства аммиака В водном растворе аммиак образует непрочное соединение – гидрат аммиака NH3 • H2O,
- 10. Методы получения аммиака На производстве N2 + 3H2 = 2NH3 (Катализатор - Fe) В лаборатории Ca(OH)2
- 11. Применение аммиака В промышленности В холодильных установках Для производства минеральных удобрений Для производства азотной кислоты Для
- 12. Домашнее задание Задача 1 Вычислите массу соли, образовавшейся в результате взаимодействия 5,4 г хлороводорода с 5
- 14. Скачать презентацию









 Переваривание и всасывание липидов. Транспортные формы липидов в крови. Лекция № 7
Переваривание и всасывание липидов. Транспортные формы липидов в крови. Лекция № 7 Предельные одноатомные спирты: свойства, получение, применение
Предельные одноатомные спирты: свойства, получение, применение Активные формы кислорода (АФК) Reactive Oxygen Species (ROS)
Активные формы кислорода (АФК) Reactive Oxygen Species (ROS) Особенности растворов высокомолекулярных соединений (ВМС). Вязкость растворов ВМС. Набухание. Рубежный контроль №1
Особенности растворов высокомолекулярных соединений (ВМС). Вязкость растворов ВМС. Набухание. Рубежный контроль №1 Ионы. Ионная связь.
Ионы. Ионная связь. Упражнения. Масс-спектрометрия
Упражнения. Масс-спектрометрия Звездный час по химии
Звездный час по химии Кремний и его соединения
Кремний и его соединения Основные понятия химии
Основные понятия химии Интерактивная интеллектуальная игра Юный химик
Интерактивная интеллектуальная игра Юный химик Химические уравнения. 8 класс
Химические уравнения. 8 класс Различные типы неорганических полимеров
Различные типы неорганических полимеров Растворение
Растворение Основания. Как называют основания?
Основания. Как называют основания?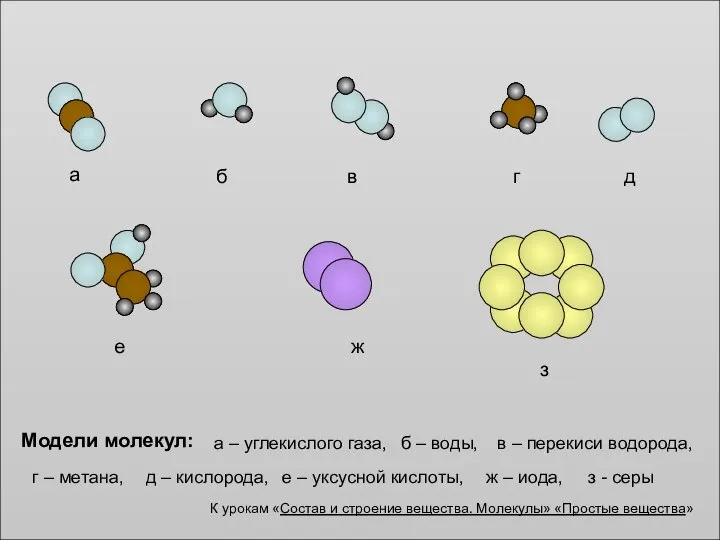 Модели молекул
Модели молекул Строение атома
Строение атома Ковалентная полярная связь
Ковалентная полярная связь Количество вещества - моль
Количество вещества - моль Гетероциклические соединения. Нуклеиновые кислоты. (Лекция 9)
Гетероциклические соединения. Нуклеиновые кислоты. (Лекция 9) Закон сохранения массы веществ. Типы химических реакций
Закон сохранения массы веществ. Типы химических реакций Использование информационных технологий в образовательном процессе на примере химии
Использование информационных технологий в образовательном процессе на примере химии Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов
Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов Химическая связь
Химическая связь Типы химических реакций. Класс оксиды
Типы химических реакций. Класс оксиды ФБОУ- Раздольненская средняя общеобразовательная школа №19 Новосибирского района Новосибирской области
ФБОУ- Раздольненская средняя общеобразовательная школа №19 Новосибирского района Новосибирской области 9 кл Урок 7 Розчинність речовин
9 кл Урок 7 Розчинність речовин Классификация гетероциклических соединений на основе их химического строения. Противоопухолевые средства
Классификация гетероциклических соединений на основе их химического строения. Противоопухолевые средства Бутан как хладагент
Бутан как хладагент