Слайд 2Альдегиды - органические вещества, содержащие функциональную альдегидную группу.
O
R—C общая формула

H
Слайд 3Изомерия и номенклатура
Для альдегидов характерна изомерия углеводородного радикала. Названия альдегидов происходят

от исторических названий соответствующих органических кислот, в которые они превращаются при окислении. По международной номенклатуре названия альдегидов происходят от названий соответствующих углеводородов с прибавлением суффикса -АЛЬ.
Слайд 4Важнейшие представители альдегидов и их названия
O метаналь или формальдегид
H—C (альдегид муравьиной

кислоты)
H
O этаналь или ацетальдегид
СH3—С (альдегид уксусной кислоты)
H
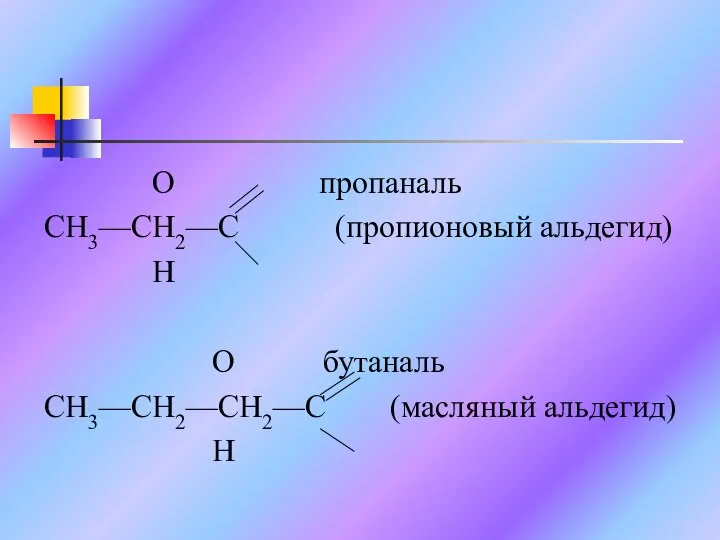
Слайд 5 O пропаналь
CH3—CH2—C (пропионовый альдегид)
H
O бутаналь
CH3—CH2—CH2—C (масляный альдегид)
H
Слайд 6 O
CH3—CH2—CH2—CH2—C
H
пентаналь (валериановый альдегид)
O
CH3—CH2—CH2—CH2—CH2—C
H
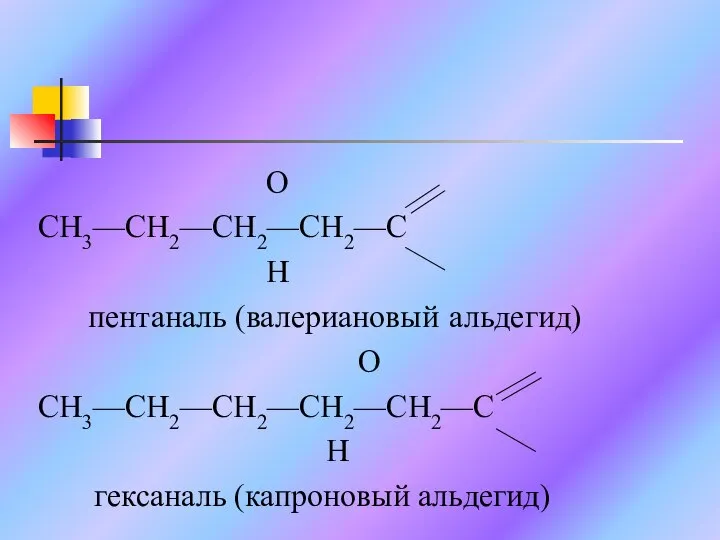
гексаналь (капроновый альдегид)
Слайд 7Физические свойства
Метаналь - бесцветный газ с резким запахом. Раствор метаналя в воде

(35 - 40%-ный) называется формалином. Остальные члены ряда альдегидов - жидкости, а высшие альдегиды-твердые.
Слайд 8Химические свойства
1.Реакции окисления
1)Качественной реакцией на альдегиды является реакция "серебряного зеркала«
O

t, аммиачный раствор O
R—C +Ag2O R—C +2Ag
H H
Слайд 92)Другой характерной реакцией является окисление альдегидов гидроксидом меди (II):
O t O
R—C
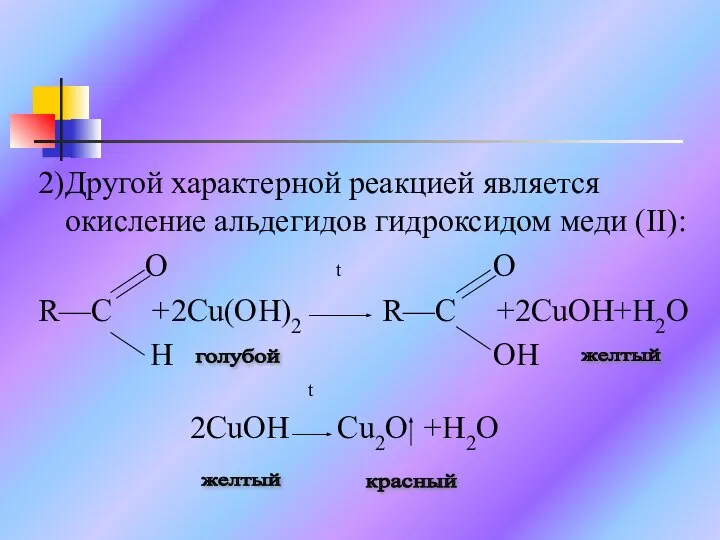
+2Cu(OH)2 R—C +2CuOH+H2O
H OH
t
2CuOH Cu2O +H2O
желтый
голубой
желтый
красный
Слайд 10Реакции присоединения
O t, кат.
H—C +H2 H3C—OH
H
Аналогично присоединяют водород и другие
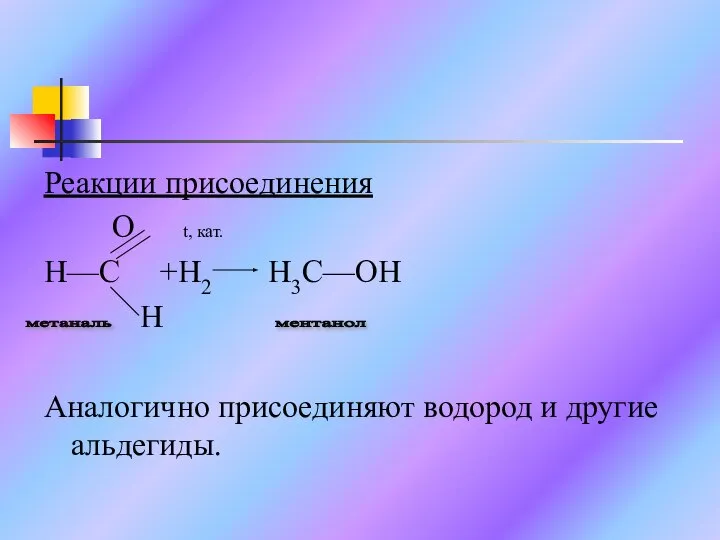
альдегиды.
ментанол
метаналь
Слайд 11Получение альдегидов
В лаборатории альдегиды получают окислением первичных спиртов. В качестве окислителей

применяют оксид меди (II), пероксид водорода
Слайд 12В промышленности альдегиды получают различными способами: а) окислением метана кислородом воздуха в
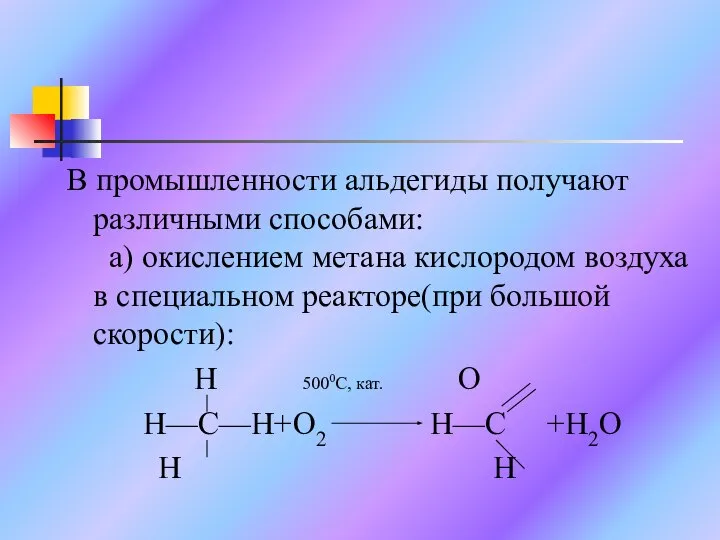
специальном реакторе(при большой скорости):
H 5000C, кат. O
H—C—H+O2 H—C +H2O
H H
Слайд 13б) метаналь получают также окислением метанола, пропуская его пары вместе с воздухом

через реактор с раскаленной медной или серебряной сеткой:
Cu или Ag O
2СH3OH+O2 2H—C +2H2O
H
Слайд 14в) этаналь можно получить и гидратацией ацетилена в присутствии солей ртути в
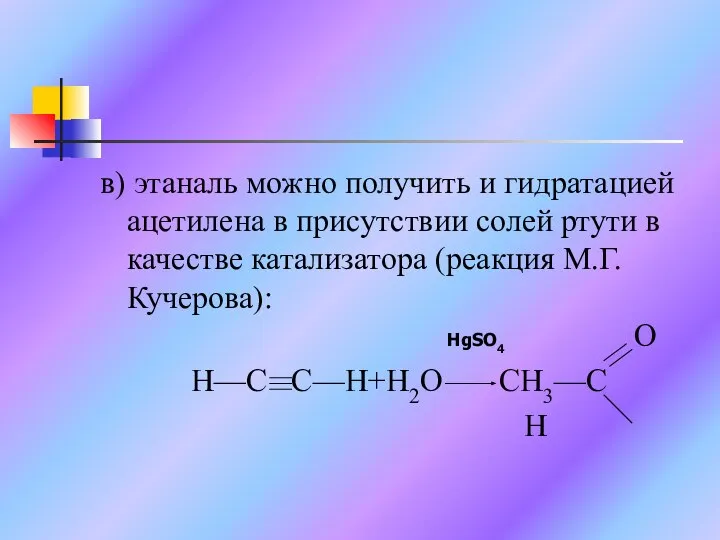
качестве катализатора (реакция М.Г.Кучерова):
HgSO4 O
H—C C—H+H2O CH3—C
H
Слайд 15Применение альдегидов
Немецкий химик А.И. Байер в 1872г. из фенола и формальдегида получил

смолообразный продукт.
Бельгийский ученый Л.Х. Бакеланд разработал способ получения этого вещества в промышленности. Так с 1912г. производится фенолформальдегидная смола, названная бакелитом.














 Топливо и расчеты его горения
Топливо и расчеты его горения Задача на химическое равновесие
Задача на химическое равновесие Презентация на тему Электролиз
Презентация на тему Электролиз  Типы реакций в неорганической химии. Гидролиз. Электролиз
Типы реакций в неорганической химии. Гидролиз. Электролиз Повторение пройденного
Повторение пройденного 8-9-10 химические формулы
8-9-10 химические формулы Prezentatsia_k_uroku
Prezentatsia_k_uroku Карбоновые кислоты, их строение, номенклатура, получение и свойства
Карбоновые кислоты, их строение, номенклатура, получение и свойства Вещество. Простые и сложные вещества
Вещество. Простые и сложные вещества Методология пробoотбора с использованием ТЧЭ
Методология пробoотбора с использованием ТЧЭ Значение периодического закона для современной науки и техники (связь химии с экономикой и экологией) Учитель химии МОУ лицея
Значение периодического закона для современной науки и техники (связь химии с экономикой и экологией) Учитель химии МОУ лицея  Химическая термодинамика
Химическая термодинамика Химический опыт с горением борноэтилового эфира
Химический опыт с горением борноэтилового эфира Определение степеней окисления и расстановка коэффициентов в ОВР
Определение степеней окисления и расстановка коэффициентов в ОВР Строение атома
Строение атома Презентация на тему Свойства простых веществ
Презентация на тему Свойства простых веществ  Газообразные дисперсные системы (Аэрозоли)
Газообразные дисперсные системы (Аэрозоли) metally_mikhaylets
metally_mikhaylets Презентации 1 строение атома
Презентации 1 строение атома Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты)
Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты) Жиры. Техническая переработка жиров
Жиры. Техническая переработка жиров Силикатная промышленность
Силикатная промышленность Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия
Арены. Электронное строение молекулы бензола. Гомологический ряд аренов, номенклатура, изомерия Никель и его соединения
Никель и его соединения Презентация на тему Электронное и пространственное строение молекулы метана
Презентация на тему Электронное и пространственное строение молекулы метана  Растворы. Процесс растворения (2)
Растворы. Процесс растворения (2)