Содержание
- 2. До вуглеводів відносять численну групу природних і синтетичних сполук, які є за хімічною будовою полігідроксильними речовинами,
- 3. Енергетична (забезпечують до 70% добового енергопостачання; добова потреба в раціоні людини складає 450-500г) структурна (входять до
- 4. В залежності від числа моносахаридних одиниць, зв'язаних в молекулу, вуглеводи діляться на прості та складні. Прості
- 5. КЛАСИФІКАЦІЯ МОНОСАХАРИДІВ В залежності від природи карбоксильної групи поділяють на АЛЬДОЗИ (альдегідна група) І КЕТОЗИ (
- 6. КЛАСИФІКАЦІЯ СКЛАДНИХ ВУГЛЕВОДІВ Олігосахариди (дисахариди), утворюють при гідролізі від двох до десяти молекул моносахаридів. Дисахариди в
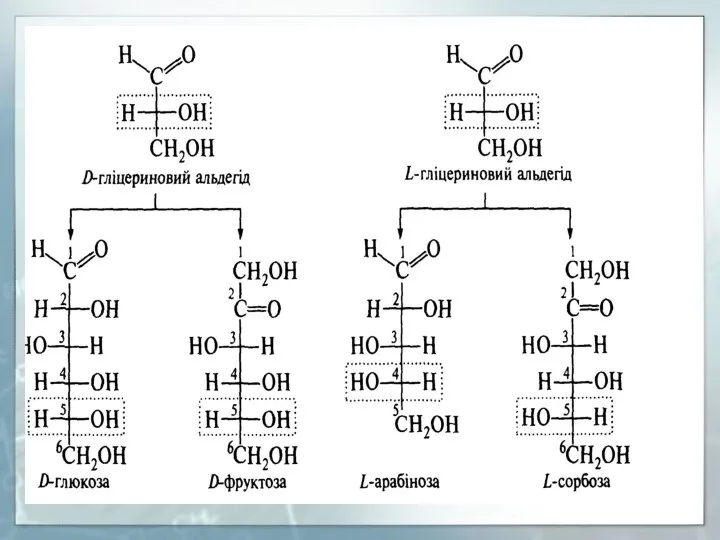
- 7. СТЕРЕОІЗОМЕРІЯ ТА БУДОВА МОНОСАХАРИДІВ Молекули моносахаридів містять декілька атомів вуглецю і тому існують у вигляді різних
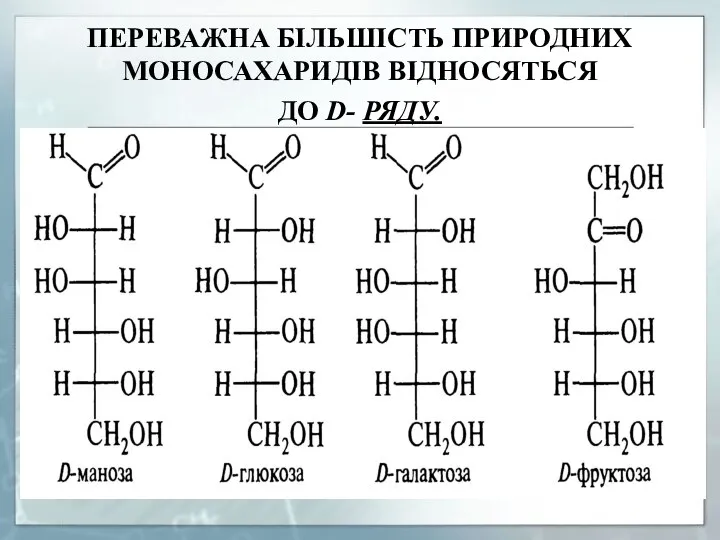
- 9. ПЕРЕВАЖНА БІЛЬШІСТЬ ПРИРОДНИХ МОНОСАХАРИДІВ ВІДНОСЯТЬСЯ ДО D- РЯДУ.
- 10. Стереоізомери різняться просторовим розташуванням замісників біля одного або кількох асиметричних вуглецевих атомів і не є дзеркальним
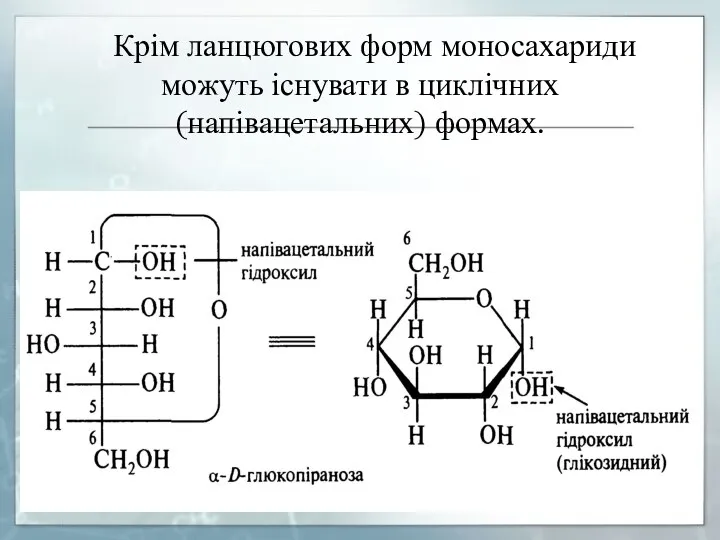
- 11. Крім ланцюгових форм моносахариди можуть існувати в циклічних (напівацетальних) формах. ПРОЦЕС ПЕРЕХОДУ АЛЬДЕГІДНОЇ ФОРМИ В ЦИКЛІЧНУ
- 12. Для циклічних форм моносахаридів прийняті ФОРМУЛИ ХЕОРСА, в яких цикли зображають у вигляді площинних багатокутників. Шестичленний
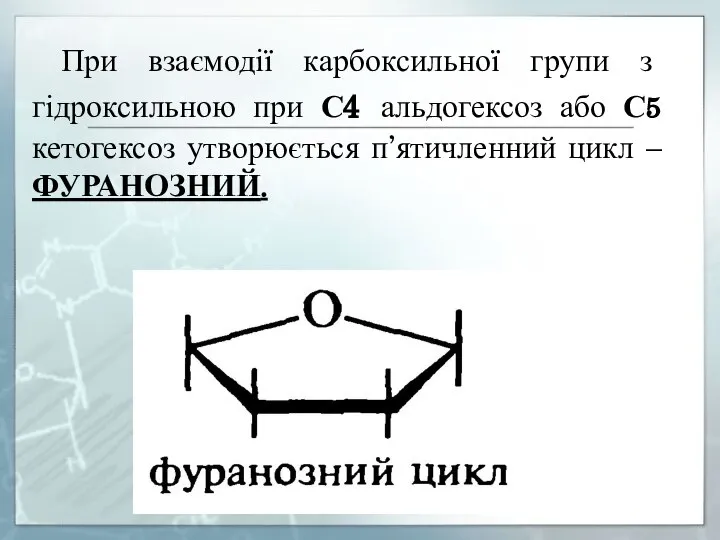
- 13. При взаємодії карбоксильної групи з гідроксильною при С4 альдогексоз або С5 кетогексоз утворюється п’ятичленний цикл –
- 14. ПРАВИЛА ПЕРЕХОДУ ВІД ФОРМУЛ (ПРОЕКЦІЙ) ФІШЕРА, ДО ФОРМУЛ ХЕОРСА 1. Здійснюють парну кількість переставлянь замісників біля
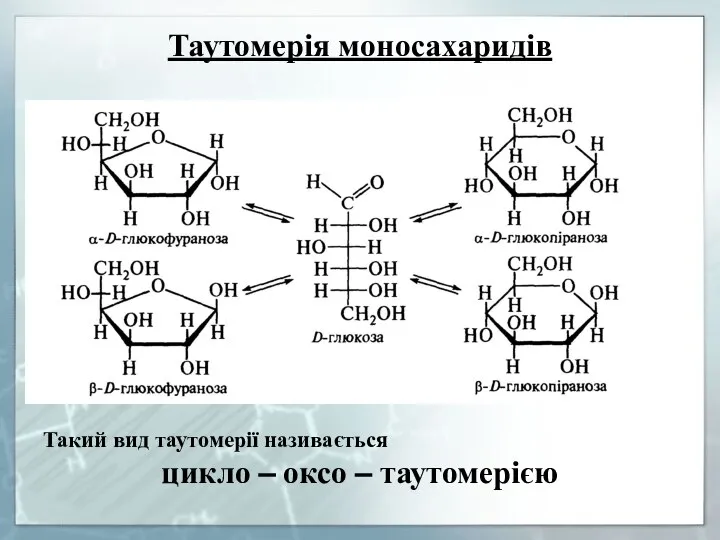
- 15. Таутомерія моносахаридів Такий вид таутомерії називається цикло – оксо – таутомерією
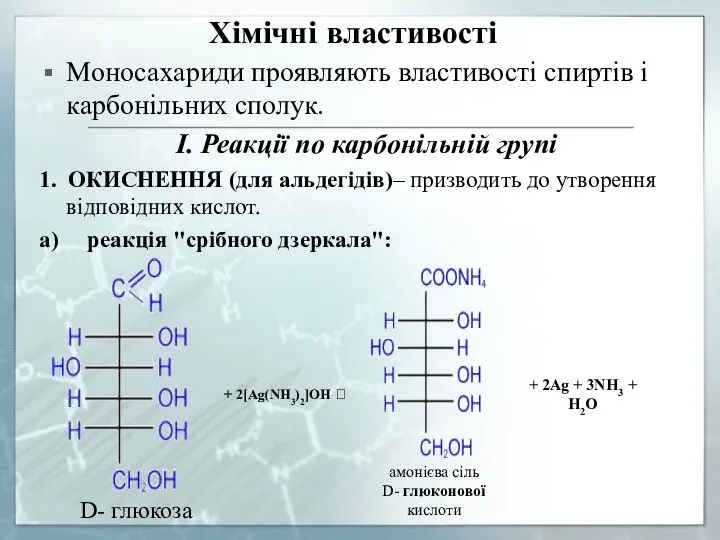
- 16. Хімічні властивості Моносахариди проявляють властивості спиртів і карбонільних сполук. I. Реакції по карбонільній групі 1. ОКИСНЕННЯ
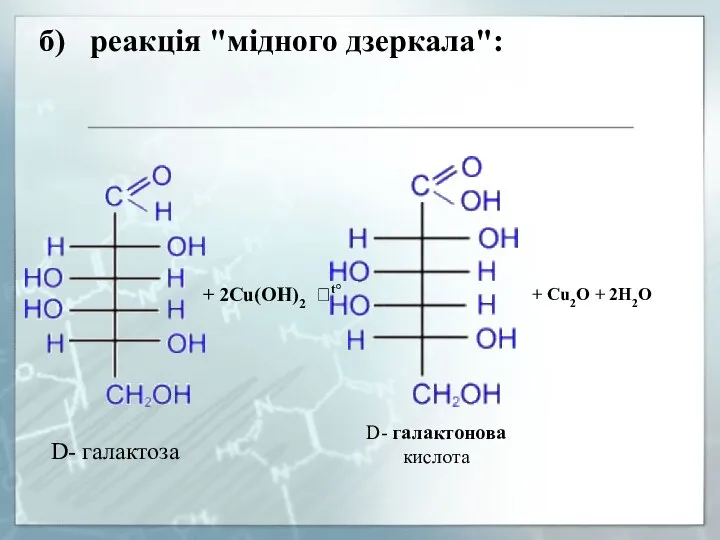
- 17. б) реакція "мідного дзеркала":
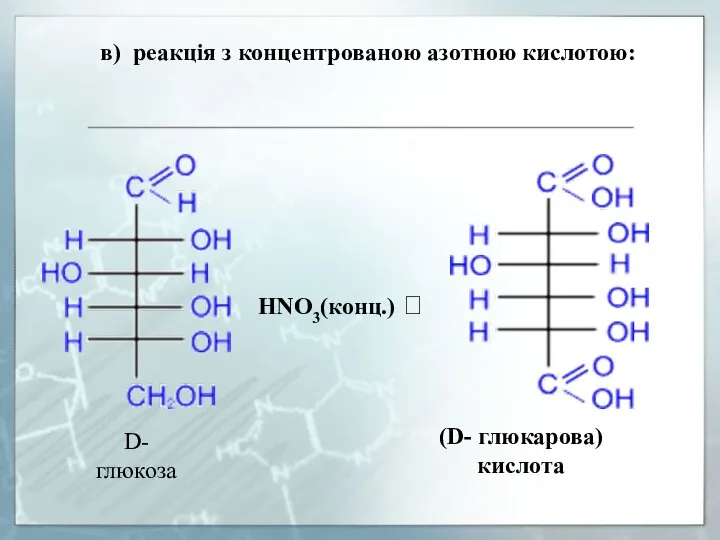
- 18. в) реакція з концентрованою азотною кислотою: D- глюкоза HNO3(конц.) ? (D- глюкарова) кислота
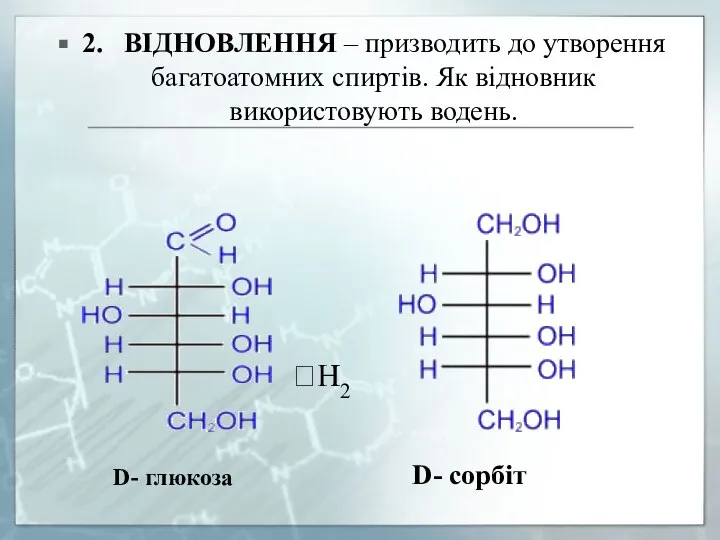
- 19. 2. ВІДНОВЛЕННЯ – призводить до утворення багатоатомних спиртів. Як відновник використовують водень.
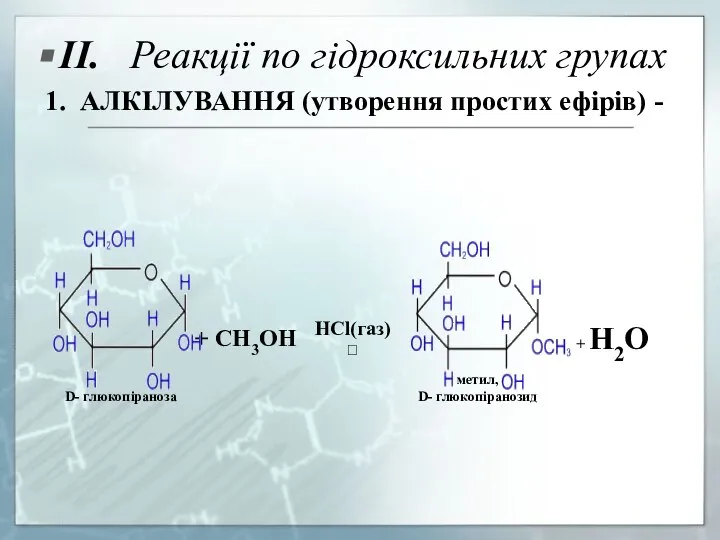
- 20. II. Реакції по гідроксильних групах 1. АЛКІЛУВАННЯ (утворення простих ефірів) -
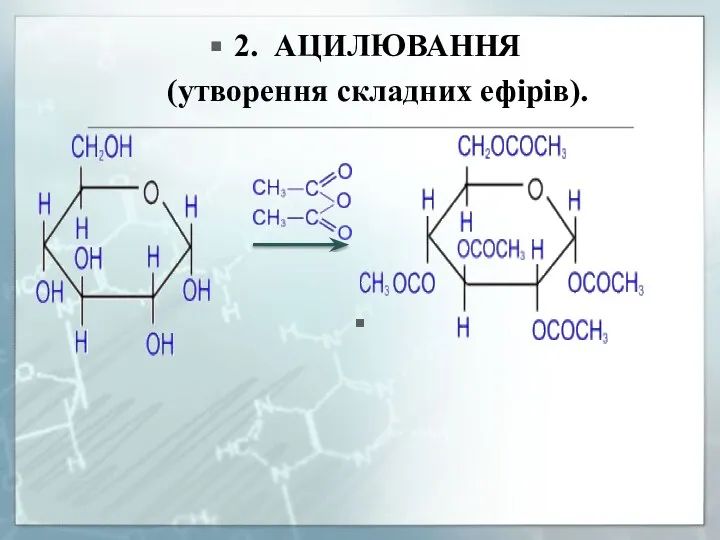
- 21. 2. АЦИЛЮВАННЯ (утворення складних ефірів).
- 22. 3. Як і всі багатоатомні спирти, глюкоза з гідроксидом міді (II) дає інтенсивне синє фарбування (ЯКІСНА
- 23. III. Специфічні реакції БРОДІННЯ - процес розщеплення молекул цукрів під впливом ферментів (ензимів): спиртове бродіння C6H12O6
- 24. Дисахариди. ДИСАХАРИДИ – при гідролізі утворюють два однакових або різних моносахариди. Загальна формула - С12Н22О11 Дисахариди
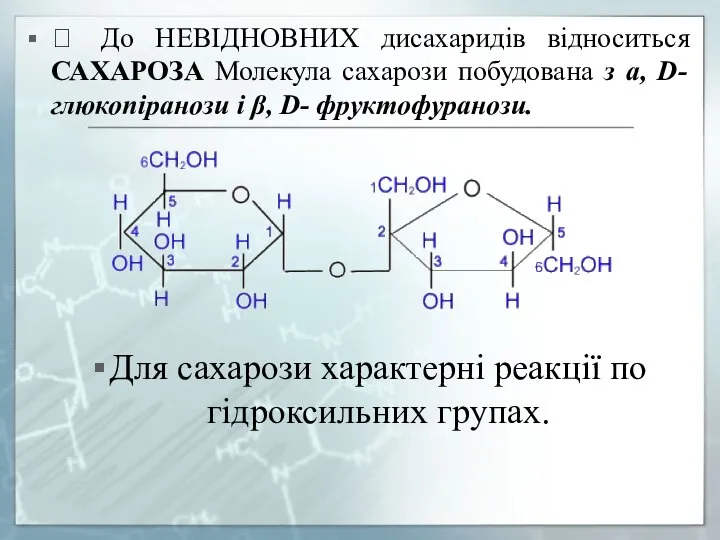
- 25. ? До НЕВІДНОВНИХ дисахаридів відноситься САХАРОЗА Молекула сахарози побудована з а, D- глюкопіранози і β, D-
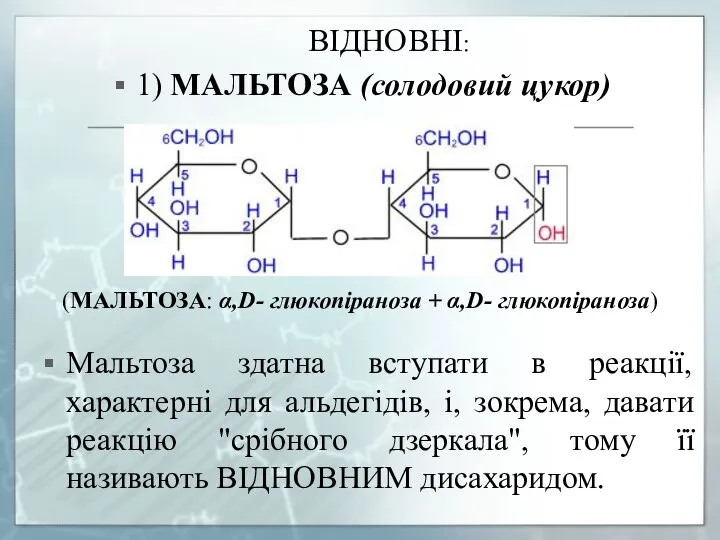
- 26. ВІДНОВНІ: 1) МАЛЬТОЗА (солодовий цукор) (МАЛЬТОЗА: α,D- глюкопіраноза + α,D- глюкопіраноза) Мальтоза здатна вступати в реакції,
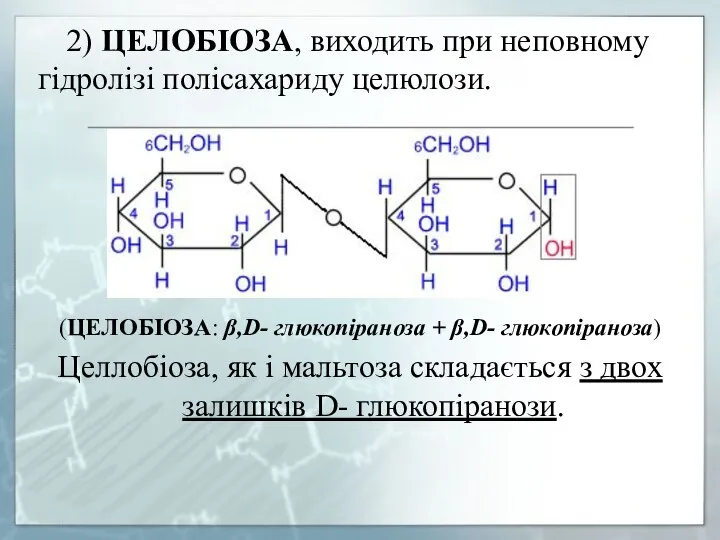
- 27. 2) ЦЕЛОБІОЗА, виходить при неповному гідролізі полісахариду целюлози. (ЦЕЛОБІОЗА: β,D- глюкопіраноза + β,D- глюкопіраноза) Целлобіоза, як
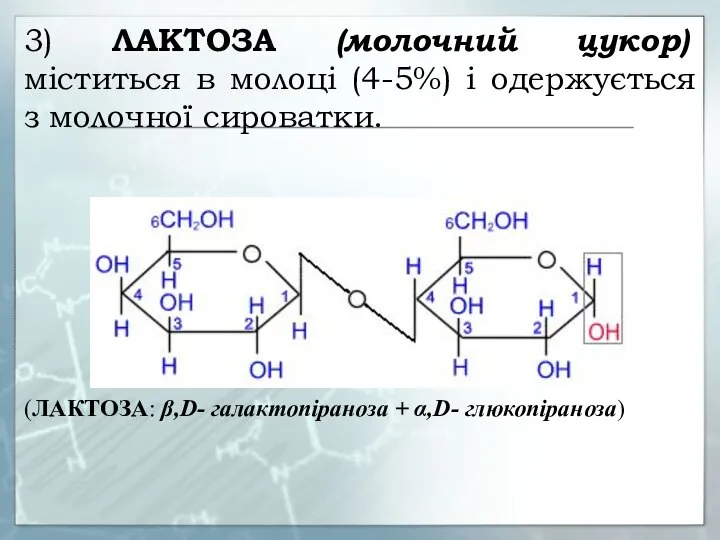
- 28. 3) ЛАКТОЗА (молочний цукор) міститься в молоці (4-5%) і одержується з молочної сироватки. (ЛАКТОЗА: β,D- галактопіраноза
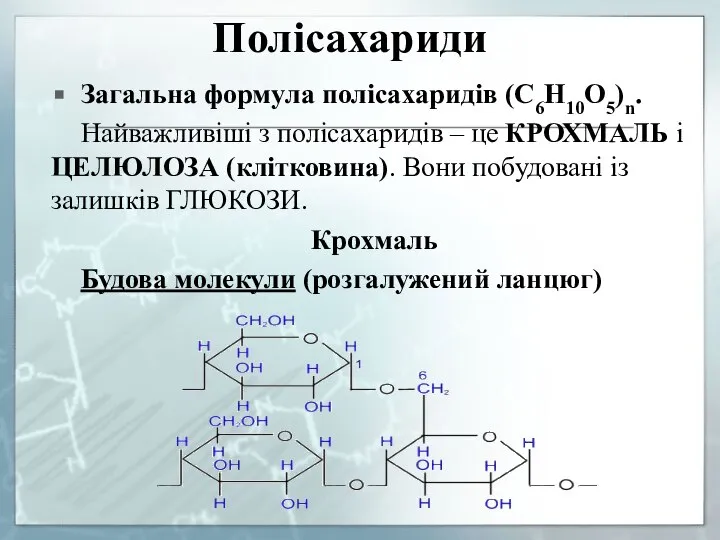
- 29. Полісахариди Загальна формула полісахаридів (C6H10O5)n. Найважливіші з полісахаридів – це КРОХМАЛЬ і ЦЕЛЮЛОЗА (клітковина). Вони побудовані
- 30. Крохмаль Хімічні властивості Крохмаль легко піддається гідролізу (C6H10O5)n(крохмаль) + nH2O → H2SO4,t nC6H12O6(глюкоза) ?Якісною реакцією на
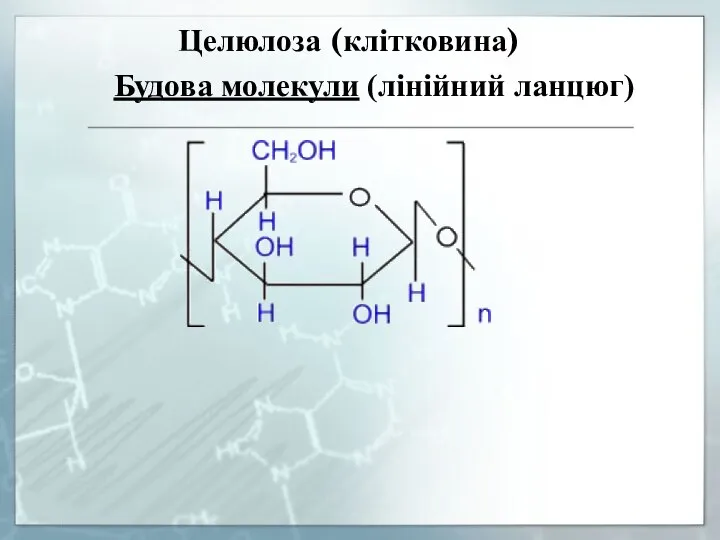
- 31. Целюлоза (клітковина) Будова молекули (лінійний ланцюг)
- 32. Хімічні властивості 1. Як і крохмаль, целюлоза при кислотному гідролізі дає глюкозу. (C6H10O5)n + nH2O –H2SO4,t
- 34. Скачать презентацию














 Предельные углеводороды
Предельные углеводороды Решение задач по органической химии
Решение задач по органической химии Получение и применение кислорода. Круговорот кислорода в природе
Получение и применение кислорода. Круговорот кислорода в природе Физические свойства полупроводников
Физические свойства полупроводников Презентация на тему Органическая химия "Жиры"
Презентация на тему Органическая химия "Жиры"  Кислород как вещество
Кислород как вещество Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік
Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік Презентация на тему Оксиды. Основания. Кислоты
Презентация на тему Оксиды. Основания. Кислоты  Алкены. Роль алкенов в жизни человека
Алкены. Роль алкенов в жизни человека Соединения галогенов
Соединения галогенов Химический анализ
Химический анализ Влияние эллементов на состав растений. Содержание тяжелого металла в растениях. Нитраты в растениях
Влияние эллементов на состав растений. Содержание тяжелого металла в растениях. Нитраты в растениях Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом
Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа
Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа Веселый химический КВН
Веселый химический КВН Синтез ацетилена из природного газа в производстве ацетилена
Синтез ацетилена из природного газа в производстве ацетилена Соединения щелочноземельных металлов
Соединения щелочноземельных металлов Кислород. Применение и круговорот в природе. 8 класс
Кислород. Применение и круговорот в природе. 8 класс Презентация по Химии "Токсическое действие неорганических веществ"
Презентация по Химии "Токсическое действие неорганических веществ"  Химия углеводов
Химия углеводов Строение атома
Строение атома Вода. Строение молекулы воды. Анализ и синтез воды
Вода. Строение молекулы воды. Анализ и синтез воды Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Практико-ориентированные задачи по химии для студентов гуманитарных специальностей
Практико-ориентированные задачи по химии для студентов гуманитарных специальностей Коррозия металлов (9 класс)
Коррозия металлов (9 класс) Углеводы. Классификация
Углеводы. Классификация Фторопласты и их использование
Фторопласты и их использование lektsia_7
lektsia_7