Содержание
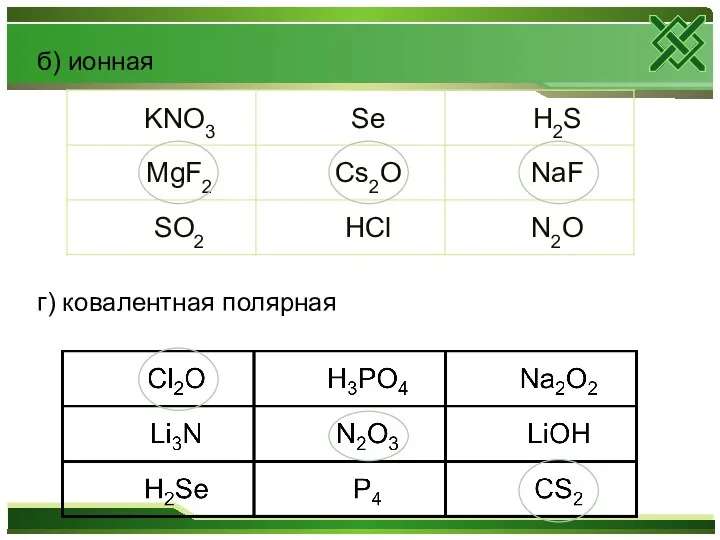
- 2. б) ионная г) ковалентная полярная
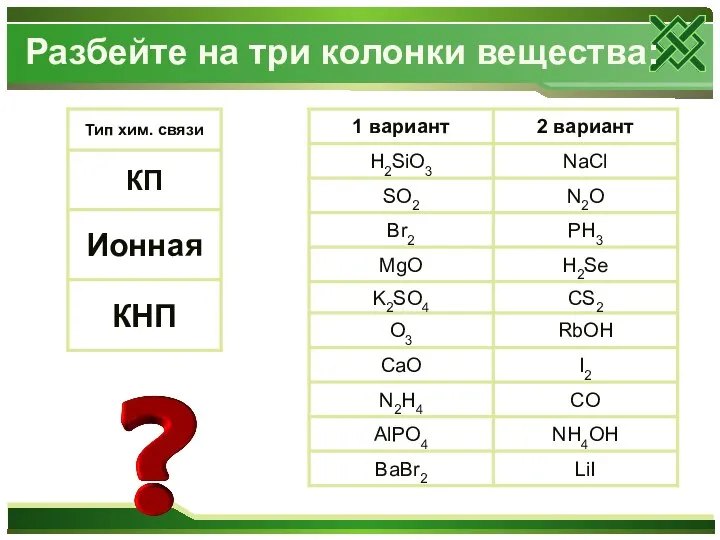
- 3. Разбейте на три колонки вещества:
- 4. Влияние Na на организм человека Хранят простое вещество «натрий» как Кощееву смерть. Как может повлиять натрий
- 5. Влияние Cl2 на организм человека Хлор – отравляющее вещество, применявшееся во время первой мировой войны
- 6. Образование сложного вещества Na0 +11 2е,8е,1е Cl0 +17 2e,8e,7e Какой вид связи может образоваться между этими
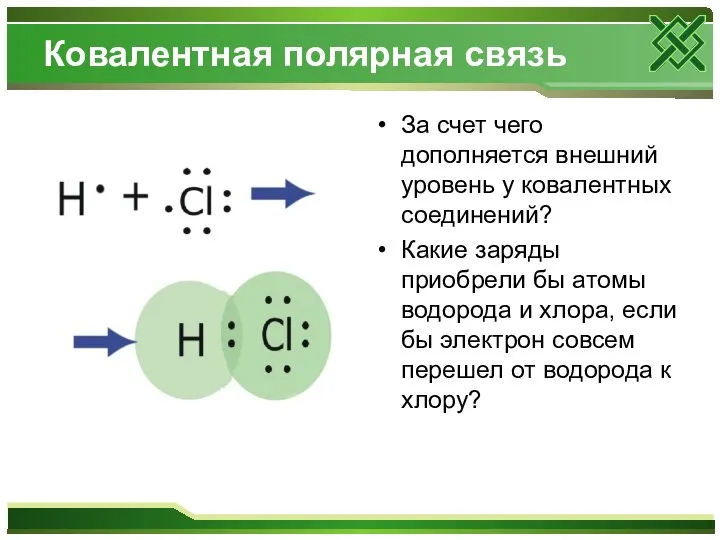
- 7. Ковалентная полярная связь За счет чего дополняется внешний уровень у ковалентных соединений? Какие заряды приобрели бы
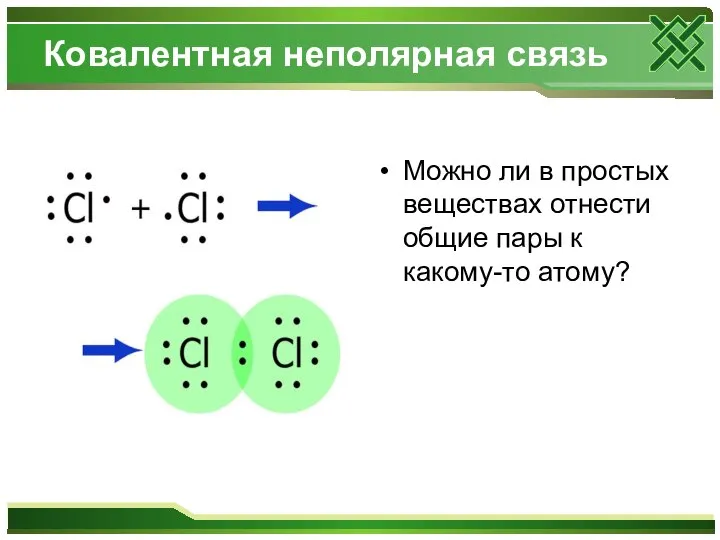
- 8. Ковалентная неполярная связь Можно ли в простых веществах отнести общие пары к какому-то атому?
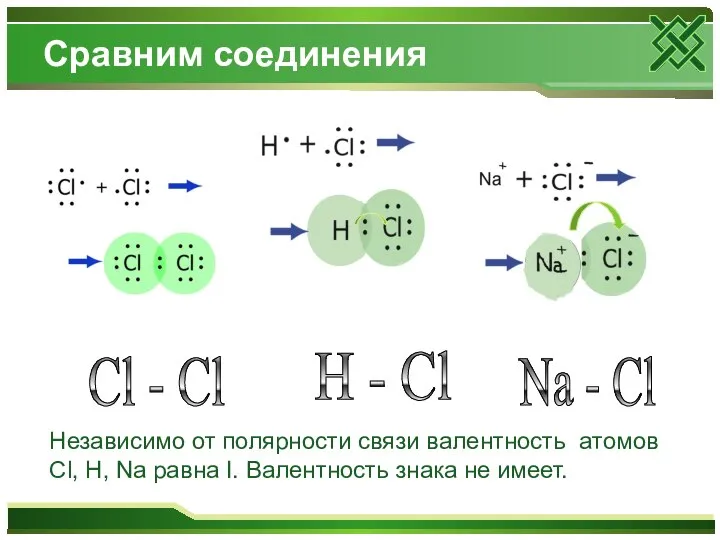
- 9. Сравним соединения H - Cl Cl - Cl Na - Cl Независимо от полярности связи валентность
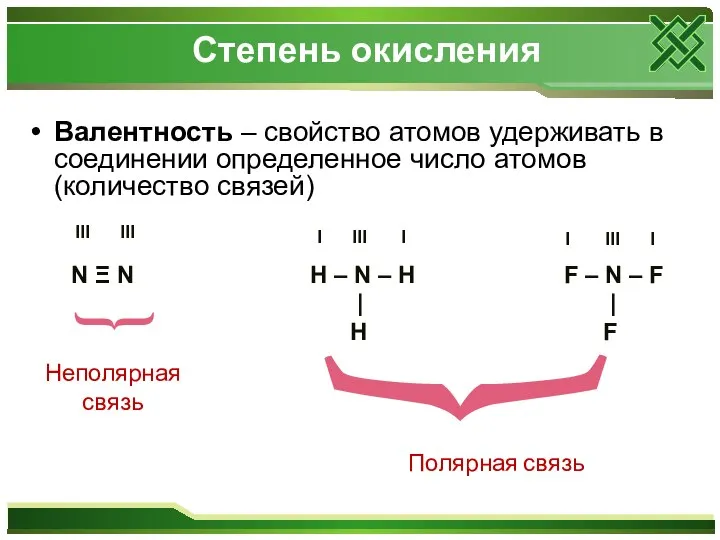
- 10. Степень окисления Валентность – свойство атомов удерживать в соединении определенное число атомов (количество связей) N Ξ
- 11. Степень окисления 8 класс
- 12. Степень окисления – это условный заряд атомов химических элементов в соединении, вычисленный на основе предположения, что
- 13. Правила определения с.о. С.о. атомов в простых веществах = 0 С.о. фтора = -1 С.о. кислорода
- 14. Возможные с.о. Положительная «+» равна числу отданных электронов. Максимальная с.о. равна номеру группы Отрицательная «-» равна
- 15. Промежуточные с.о. Рассмотрим возможные с.о. серы – S Максимальная +6 SO3 Минимальная -2 H2S Сера может
- 16. Определение с.о. N2O3 На первом месте стоит элемент с «+» с.о., на втором с «-» У
- 17. План определения степени окисления элементов в соединениях 1. Степень окисления атомов в простых веществах равна нулю.
- 18. 3. Определите наиболее электроотрицательный элемент и направление смещения общих электронных пар. Расставьте степени окисления элементов. N2O,
- 19. Определяем степени окисления известных элементов. H2SO4 +1 X -2 2. Для определения степени окисления неизвестного элемента
- 20. 1. Определите степень окисления атомов в соединении. Задания CH4, KCl, AlI3, P2O5. -4 +1 +1 -1
- 21. Задание 1 Определите С.О. по формулам Cl2O7, NaH, Na2S, MgO, H3N, N2, Al2S3, Cu2O
- 23. Скачать презентацию














 Periodická tabuľka prvkov PTP
Periodická tabuľka prvkov PTP ОВ. Структура и принцип работы параметры ОВ
ОВ. Структура и принцип работы параметры ОВ Когда образуется кислая соль?
Когда образуется кислая соль? Презентация на тему Генетическая связь между классами неорганических вещ-в
Презентация на тему Генетическая связь между классами неорганических вещ-в  Легированные стали
Легированные стали Соединения алюминия
Соединения алюминия Ориентация полимеров
Ориентация полимеров Презентация на тему Сплавы металлов (9 класс)
Презентация на тему Сплавы металлов (9 класс)  ліпіди
ліпіди Производство чугуна и стали
Производство чугуна и стали Окислительно-восстановительные реакции, 9 класс
Окислительно-восстановительные реакции, 9 класс Презентация на тему Твердые вещества
Презентация на тему Твердые вещества 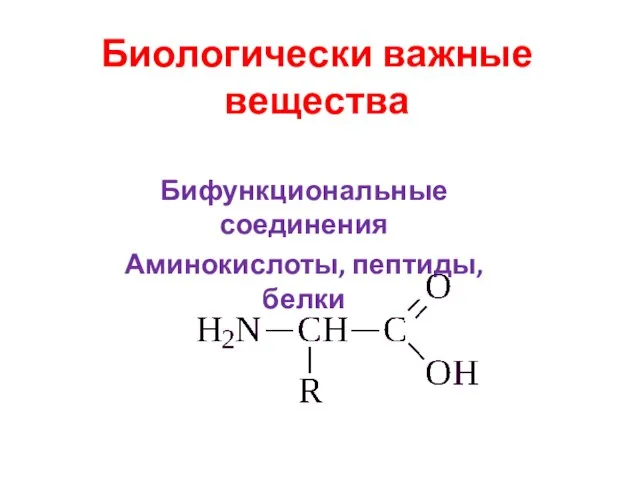 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Химические реакции (игра)
Химические реакции (игра) Физические и фазовые состояния полимеров
Физические и фазовые состояния полимеров Признаки реакции
Признаки реакции ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ. Арены. 10 класс
Арены. 10 класс Электролитическая диссоциация
Электролитическая диссоциация Химия – наука о веществах. Вычисления по химическим формулам. Тема 1
Химия – наука о веществах. Вычисления по химическим формулам. Тема 1 Алкины (Ацетилены)
Алкины (Ацетилены) Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Алканы
Алканы Оксиды в мире минералов
Оксиды в мире минералов Классификация органических соединений
Классификация органических соединений Язык естествознания. Химия
Язык естествознания. Химия Обращеннофазовая хроматография высокого разрешения RP HPLC
Обращеннофазовая хроматография высокого разрешения RP HPLC Химические реакции
Химические реакции