Содержание
- 2. Строение молекулы К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Свойство «непредельности»
- 3. Орбитали атомов углерода, между которыми имеется двойная связь, находятся в состоянии sp2-гибридизации. Это означает, что в
- 4. Оси гибридных орбиталей атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π-связь, располагаются
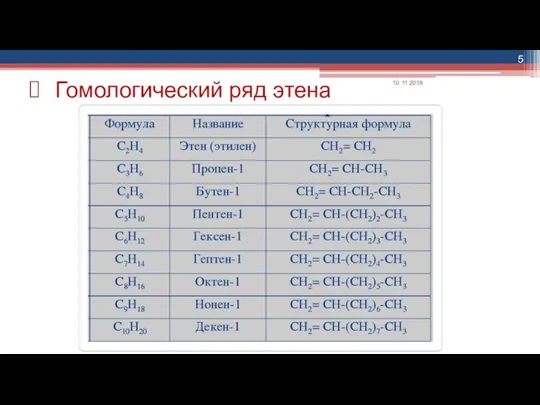
- 5. Гомологический ряд этена 10.11.2018
- 6. Изомерия и номенклатура Структурная изомерия 1) изомерия углеродного скелета: 2) изомерия положения двойной связи: 10.11.2018
- 7. Межклассовая изомерия Алкены изомерны циклоалканам, например: Пространственная (геометрическая) изомерия Вращение вокруг двойной связи невозможно, что приводит
- 8. 1. Определения главной цепи – самой длинной цепочки атомов углерода в молекуле. Главная цепь должна содержать
- 9. Получение алкенов Рассмотрим основные способы получения алкенов в промышленности в лаборатории 10.11.2018
- 10. Получение – в промышленности Крекинг нефтепродуктов. В процессе термического крекинга предельных углеводородов наряду с образованием алканов
- 11. Дегидратация спиртов (отщепление воды). Воздействие водоотнимающих средств (H2SO4, Al2O3) на одноатомные спирты при высокой температуре приводит
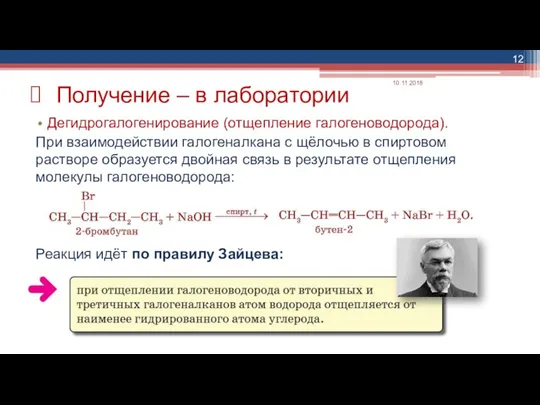
- 12. Дегидрогалогенирование (отщепление галогеноводорода). При взаимодействии галогеналкана с щёлочью в спиртовом растворе образуется двойная связь в результате
- 13. Дегалогенирование. При действии цинка или магния на дибромпроизводное алкана происходит отщепление атомов галогенов, находящихся при соседних
- 14. Химические свойства алкенов Реакции присоединения Реакции полимеризации Реакции окисления 10.11.2018
- 15. Химические свойства Отличительной чертой представителей непредельных углеводородов - алкенов является способность вступать в реакции присоединения. Гидрирование
- 16. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (CCl4) приводит
- 17. Гидрогалогенирование (присоединение галогеноводорода): Эта реакция подчиняется правилу Марковникова: Химические свойства ? 10.11.2018
- 18. Гидратация (присоединение воды). Гидратация алкенов приводит к образованию спиртов. При присоединении воды к этену образуется первичный
- 19. Реакция полимеризации – особый случай реакции присоединения: Реакции полимеризации веществ, содержащих двойную связь, используют для получения
- 20. Реакции окисления Алкены горят в кислороде с образованием CO2 и H2O: Алкены легко окисляются под действием
- 21. Применение алкенов Алкены широко используются в химической промышленности как сырьё для получения разнообразных органических веществ и
- 23. Скачать презентацию


















 Электролитическая диссоциация
Электролитическая диссоциация Строение , свойства и биологическая роль гликолипидов. Тема 14
Строение , свойства и биологическая роль гликолипидов. Тема 14 Презентация на тему Азотная кислота и ее свойства
Презентация на тему Азотная кислота и ее свойства  Железо и его соединения
Железо и его соединения Эфирные масла
Эфирные масла Электролиз воды
Электролиз воды Действие активированного угля
Действие активированного угля Кислоты. К уроку по химии для 8 класса
Кислоты. К уроку по химии для 8 класса Основы химической термодинамики
Основы химической термодинамики Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини
Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды
Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды АКТИВІЗАЦІЯ ТВОРЧОЇ ДІЯЛЬНОСТІ УЧНІВ У ПРОЦЕСІ СТВОРЕННЯ І ВИКОРИСТАННЯ ПРОЕКТІВ У POWER POINT НА УРОКАХ ХІМІЇ
АКТИВІЗАЦІЯ ТВОРЧОЇ ДІЯЛЬНОСТІ УЧНІВ У ПРОЦЕСІ СТВОРЕННЯ І ВИКОРИСТАННЯ ПРОЕКТІВ У POWER POINT НА УРОКАХ ХІМІЇ Установочная лекция по специальной химии для студентов специальности Прикладная геология
Установочная лекция по специальной химии для студентов специальности Прикладная геология Алканы. Физические свойствава алканов
Алканы. Физические свойствава алканов 01_Khimicheskiy_sostav
01_Khimicheskiy_sostav Технологические процессы получения кислорода
Технологические процессы получения кислорода Кристаллическая структура вещества. Характеристика вещества по формуле
Кристаллическая структура вещества. Характеристика вещества по формуле Гипер-гипофосфатемия
Гипер-гипофосфатемия Презентация на тему Неорганические кислоты
Презентация на тему Неорганические кислоты  Золото. Золотые сплавы
Золото. Золотые сплавы Кафедра общей и биоорганической химии
Кафедра общей и биоорганической химии Получение этилового спирта из древесины
Получение этилового спирта из древесины Явления
Явления Определение времени прохождения диффузии
Определение времени прохождения диффузии Превращение веществ. История химии. Автор: Рассказова Н.Л., учитель химии и биологии МОУ «СОШ №8».
Превращение веществ. История химии. Автор: Рассказова Н.Л., учитель химии и биологии МОУ «СОШ №8». Метил-трет-бутиловый эфир
Метил-трет-бутиловый эфир Prezentatsia_Microsoft_PowerPoint
Prezentatsia_Microsoft_PowerPoint Алкины
Алкины