Содержание
- 2. Сегодня на уроке мы должны: записать молекулярную и структурную формулы азотной кислоты; изучить химические свойства азотной
- 3. N2O5 HNO3 Ст/о (N) = + 5
- 4. Строение и свойства молекулы азотной кислоты: «дымится на воздухе», на свету желтеет, т. к. подвергается разложению
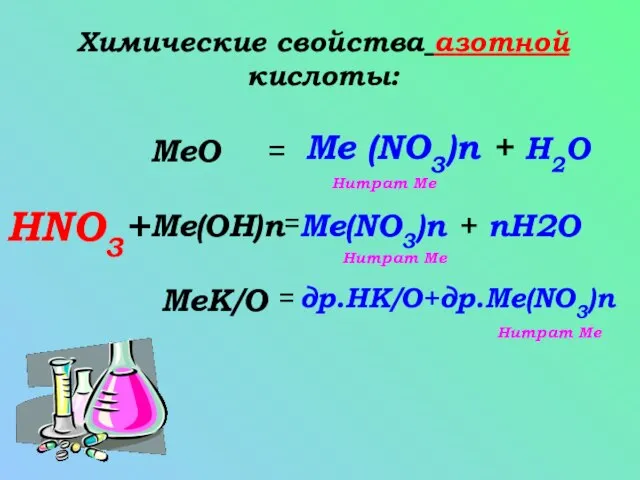
- 5. Химические свойства азотной кислоты: HNO3+ Me(OH)n MeК/О MeO = = = Me (NO3)n + H2O Me(NO3)n
- 6. Свойства концентрированной азотной кислоты: Cu + 4HNO3 = Cu(NO3)2+2H2O + 2NO2 ( конц.) Cu 0 --------
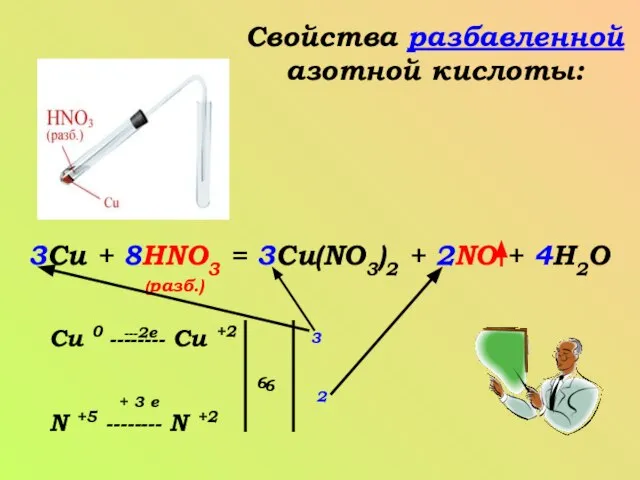
- 7. Свойства разбавленной азотной кислоты: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O (разб.) Cu 0
- 8. Специфические химические свойства концентрированной азотной кислоты Fe , Al + HNO3 ---- НЕ ВЗАИМОДЕЙСТВУЮТ, т.к. образуют
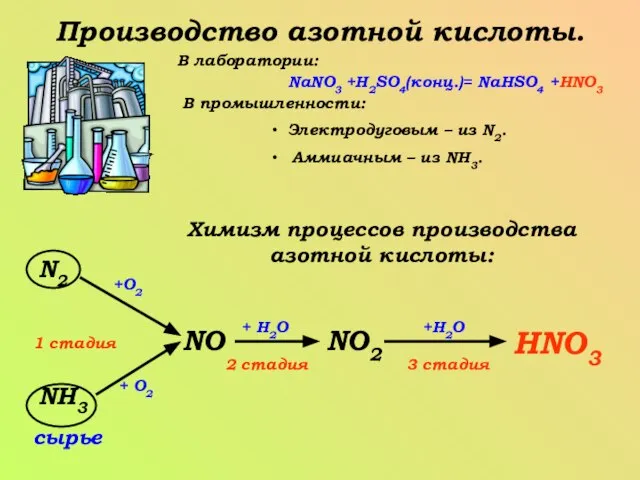
- 9. Производство азотной кислоты. В лаборатории: NaNO3 +H2SO4(конц.)= NaHSO4 +HNO3 В промышленности: Электродуговым – из N2. Аммиачным
- 10. HNO3
- 12. Скачать презентацию





 Гидролиз солей
Гидролиз солей Синтез и реакции пиридазина
Синтез и реакции пиридазина Газ тәрізді диэлектриктер. Пропан
Газ тәрізді диэлектриктер. Пропан Основные понятия и законы химии
Основные понятия и законы химии Химия в системе современных естественнонаучных представлений
Химия в системе современных естественнонаучных представлений Комплексное изучение системы NiO-ZnO-CoO с целью модифицирования свойств исходной матрицы никель-цинкового феррита xZnxFe2O4
Комплексное изучение системы NiO-ZnO-CoO с целью модифицирования свойств исходной матрицы никель-цинкового феррита xZnxFe2O4 ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски
ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски Простые и сложные вещества
Простые и сложные вещества Осторожно, химия
Осторожно, химия Коды Менделеева
Коды Менделеева Металлическая химическая связь
Металлическая химическая связь Определение плотности газообразного вещества по плотности
Определение плотности газообразного вещества по плотности Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Periodická tabuľka prvkov PTP
Periodická tabuľka prvkov PTP История создания термометра: как придумали первый градусник?
История создания термометра: как придумали первый градусник? Кислородные соединения азота, азотная кислота. Соли азотной кислоты. Удобрения
Кислородные соединения азота, азотная кислота. Соли азотной кислоты. Удобрения Основные особенности процессов растворения твёрдых веществ
Основные особенности процессов растворения твёрдых веществ Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Электрохимия. Предмет и задачи электрохимии. Теория растворов электролитов
Электрохимия. Предмет и задачи электрохимии. Теория растворов электролитов Химические уравнения
Химические уравнения Гидролиз солей
Гидролиз солей Презентация 1
Презентация 1 Органическая химия. Теория строения органических соединений
Органическая химия. Теория строения органических соединений Prezentatsia_Microsoft_PowerPoint
Prezentatsia_Microsoft_PowerPoint Основные понятия термодинамики.Первое начало термодинамики и его применимость к биосистемам. (Лекция 04)
Основные понятия термодинамики.Первое начало термодинамики и его применимость к биосистемам. (Лекция 04) Ароматические кислородсодержащие соединения
Ароматические кислородсодержащие соединения Основы переработки нефти и нефтепродуктов
Основы переработки нефти и нефтепродуктов Нобелевские лауреаты и их достижения
Нобелевские лауреаты и их достижения