Содержание
- 2. Нахождение в природе В земной коре железо распространено достаточно широко. На его долю приходится: Около 4,1%
- 3. Соединения железа Fe3O4 – магнитный железняк Fe2O3 – красный железняк (гематит) 2Fe2O3 * 3H2O – бурый
- 4. Положение железа в Периодической системе химических элементов Д. И. Менделеева
- 5. Строение атома железа
- 6. Физические свойства железа Серебристо-серый металл, ковкий, пластичный, плотность 7,87г/см3; tпл.=1539°С; tкип.=2740°С; хорошо проводит тепло и электричество,
- 7. Fе3О4 + 4СО =3Fе + 4СО2 FеО + Н2 = Fе + Н2О Fе2О3 + 2Аl
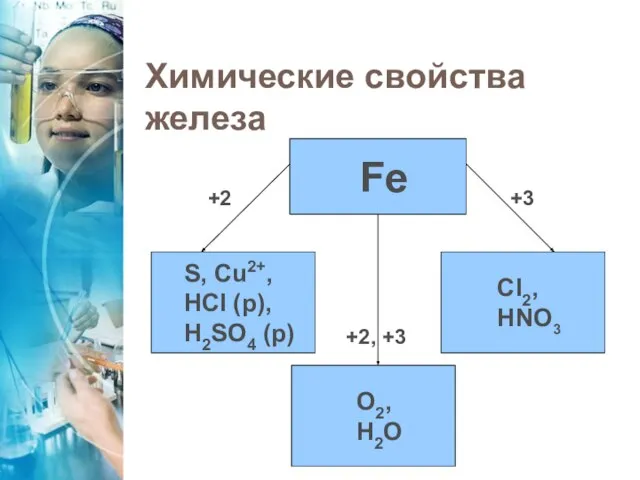
- 8. Химические свойства железа Fe S, Cu2+, HCI (р), H2SO4 (р) CI2, HNO3 O2, H2O +2 +3
- 9. Химические свойства железа
- 10. Химические свойства железа Взаимодействие железа с хлором 2Fe + 3Cl2 = 2FeCl3 https://www.youtube.com/watch?v=w6wc4PG0-es
- 11. Химические свойства железа Взаимодействие железа с кислородом 4Fe +3O2=2Fe2O3 https://www.youtube.com/watch?v=o9Rvc3Vae_c
- 12. Химические свойства железа Взаимодействия железа с серой Fe +S = FeS https://www.youtube.com/watch?v=jzEnZ6B7xNA
- 13. Химические свойства железа Реакции со сложными веществами С кислотами: А) с соляной кислотой 2HCl + Fe
- 14. Химические свойства железа Железо разрушается под действием окружающей среды, т.е. подвергается коррозии – «ржавлению». При этом
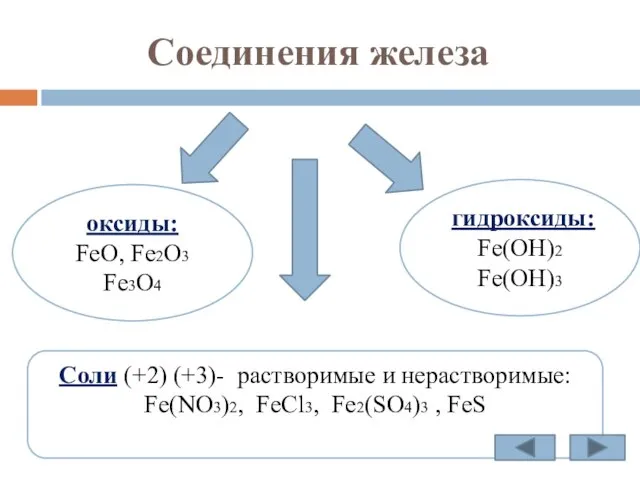
- 15. Соединения железа оксиды: FeO, Fe2O3 Fe3O4 гидроксиды: Fe(OH)2 Fe(OH)3 Соли (+2) (+3)- растворимые и нерастворимые: Fe(NO3)2,
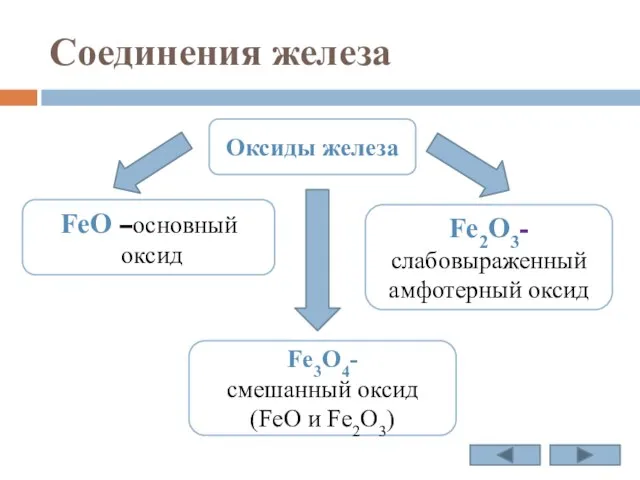
- 16. Соединения железа Оксиды железа FeO –основный оксид Fe3O4- смешанный оксид (FeO и Fe2O3) Fe2O3- слабовыраженный амфотерный
- 17. Соединения железа Химические свойства FeO 1) с кислотами: FeO + 2HCl=FeCl2 + H2O 2) с более
- 18. Соединения железа Химические свойства Fe3O4 1) с кислотами Fe3O4 + 8HCl=FeCl2 +2FeCl3 + 4H2O 2) также
- 19. Соединения железа Гидроксиды железа Fe(OH)2 Fe(OH)3
- 20. Соединения железа Fe(OH)2 и Fe(OH)3 1)Реагируют с кислотами: Fe(OH)2 + 2HNO3= Fe(NO3)2 + 2H2O Fe(OH)3 +
- 21. Качественные реакции на ионы Fe²⁺ и Fe³⁺ FeCl2 + 2NaOH=Fe(OH)2 +2NaCl Fe2+ +2Cl- + 2Na+ +
- 22. Качественные реакции на ионы Fe²⁺ На ион Fe2+ - взаимодействие с красной кровяной солью гексацианоферратом (III)калия
- 23. Качественные реакции на ионы Fe³⁺ FeCl3 + 3KSCN ? Fe(SCN)3 +3KCl роданид калия Fe+3CI3+3NH4SCN ? Fe(SCN)3↓+3NH4C
- 24. Биологическое значение железа Ионы железа входят в состав гемоглобина, который содержится в эритроцитах крови. Источники железа:
- 25. Применение Железо - самый употребляемый металл, на него приходится до 90 % мирового производства металлов. Железный
- 26. Железо не только основа всего мира, самый главный металл окружающей нас природы, оно – основа культуры
- 28. Скачать презентацию





















 Растворы. 8 класс
Растворы. 8 класс Химическая формула
Химическая формула Жиры. 10 класс
Жиры. 10 класс Функциональные свойства и анализ каротиноидов в пищевых продуктах
Функциональные свойства и анализ каротиноидов в пищевых продуктах Понятие Эффективность. Принцип Ле-Шателье
Понятие Эффективность. Принцип Ле-Шателье Природный газ
Природный газ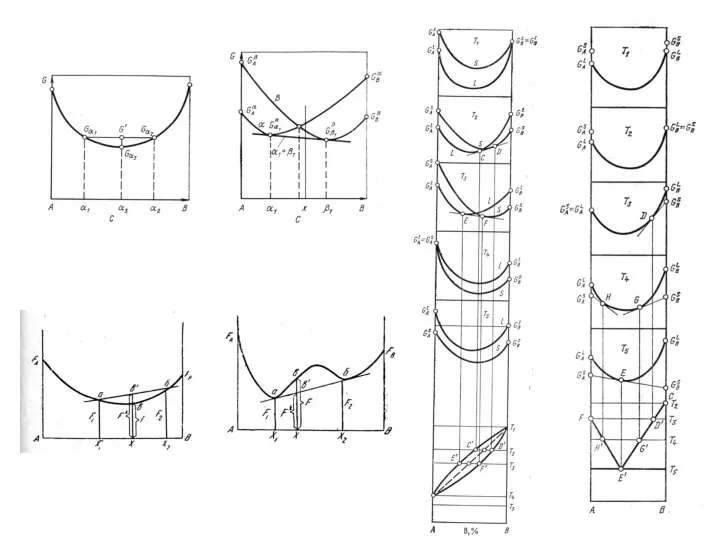 Кинетика кристаллизации сплавов
Кинетика кристаллизации сплавов Кислоты. состав, номенклатура и их их классификация
Кислоты. состав, номенклатура и их их классификация Химия и краски
Химия и краски Вода в природе. Состав, свойства и применение воды
Вода в природе. Состав, свойства и применение воды Химические реакции
Химические реакции Классификация реакций. Таблица
Классификация реакций. Таблица Кислородсодержащие органические вещества
Кислородсодержащие органические вещества Алканы
Алканы valentnost
valentnost Алканы. Строение. Изомерия и номенклатура
Алканы. Строение. Изомерия и номенклатура Щелочные металлы
Щелочные металлы Воздействие нейропептидов семакс и PGP на содержание транскриптов гена в головном мозге крыс в условиях экспериментальной ишемии
Воздействие нейропептидов семакс и PGP на содержание транскриптов гена в головном мозге крыс в условиях экспериментальной ишемии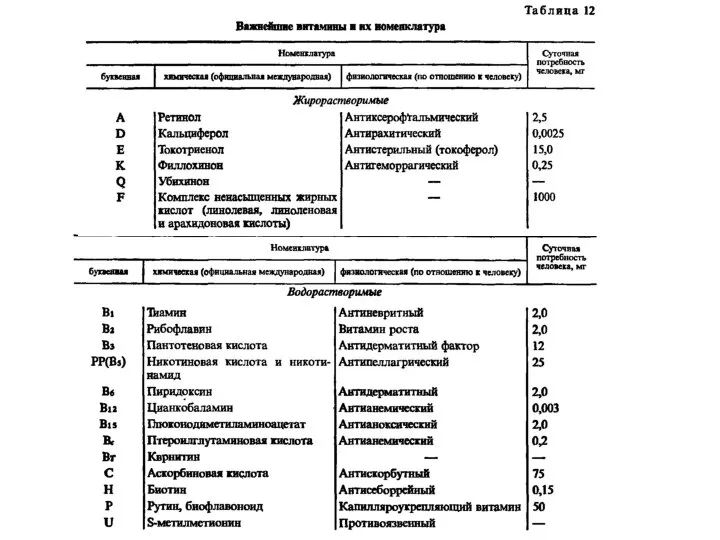 Важнейшие витамины и их номенклатура
Важнейшие витамины и их номенклатура Основной государственный экзамен. Химия 2021. Задание 17
Основной государственный экзамен. Химия 2021. Задание 17 Влияние инициаторов на реакцию полимеризации стирола
Влияние инициаторов на реакцию полимеризации стирола Тренинг по теме Валентность
Тренинг по теме Валентность Приминение серной кислоты в хозяйстве
Приминение серной кислоты в хозяйстве Ксантановая камедь
Ксантановая камедь Органика в ЕГЭ (В,С)
Органика в ЕГЭ (В,С) Первоначальные химические понятия
Первоначальные химические понятия Алканы. Получение и применение
Алканы. Получение и применение Основания как электролиты
Основания как электролиты