Содержание
- 2. Основное содержание лекции: Понятие о непредельных углеводородах. Характеристика двойной связи. Изомерия и номенклатура алкенов. Физические свойства.
- 3. Понятие об алкенах Алкены – углеводороды, содержащие в молекуле одну двойную связь между атомами углерода, а
- 4. Вид гибридизации – Валентный угол – Длина связи С = С – Строение ─ Вид связи
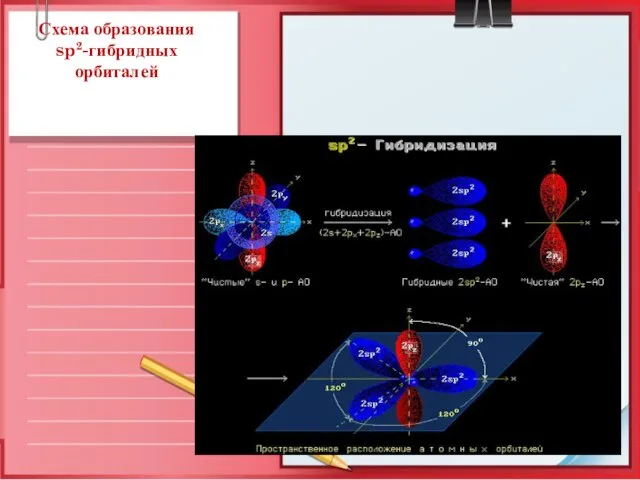
- 5. Схема образования sp2-гибридных орбиталей
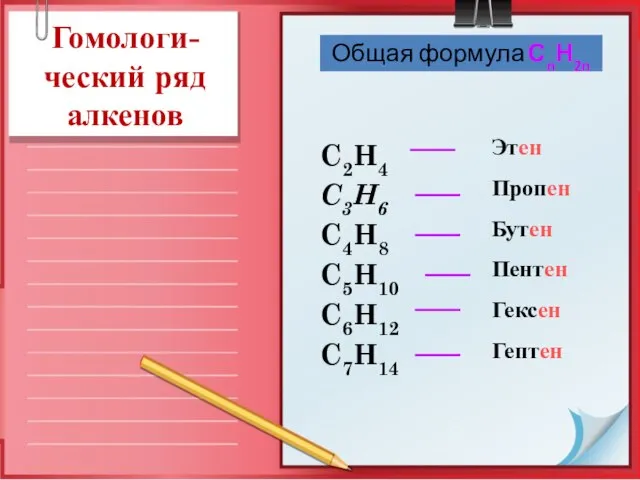
- 6. Этен Пропен Бутен Пентен Гексен Гептен C2H4 C3H6 C4H8 C5H10 C6H12 C7H14 Общая формула СnН2n Гомологи-ческий
- 7. Изомерия алкенов Для алкенов возможны два типа изомерии: 1-ый тип – структурная изомерия: углеродного скелета положения
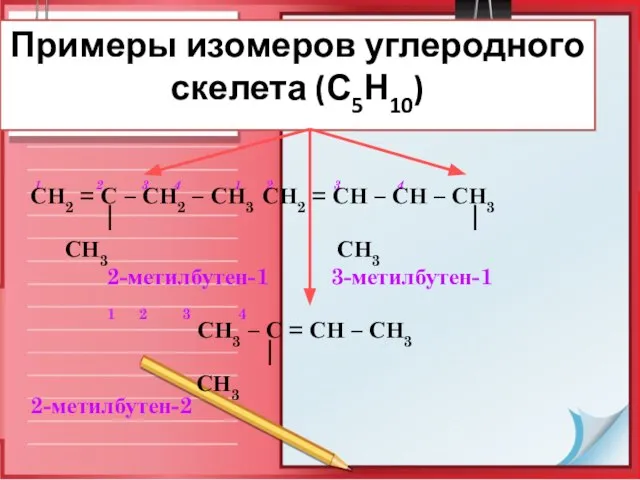
- 8. Примеры изомеров углеродного скелета (С5Н10) 1 2 3 4 1 2 3 4 СН2 = С
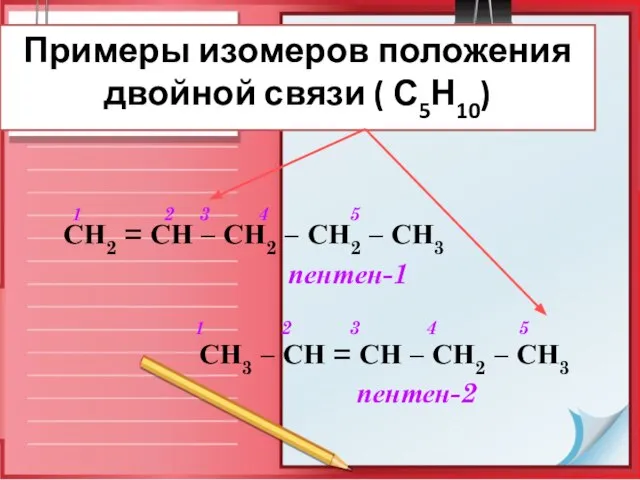
- 9. Примеры изомеров положения двойной связи ( С5Н10) 1 2 3 4 5 СН2 = СН –
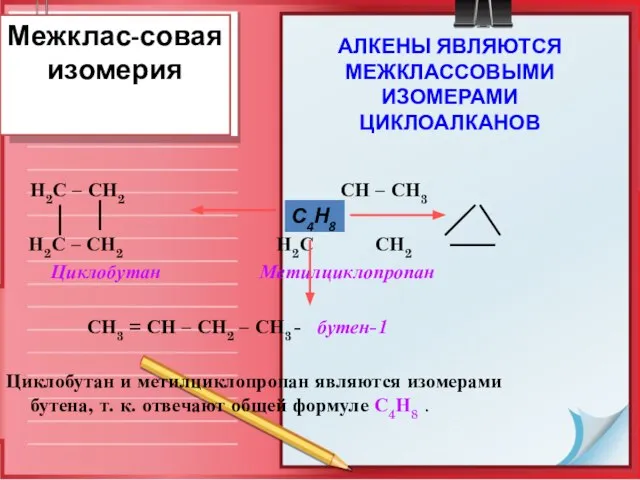
- 10. Межклас-совая изомерия Н2С – СН2 СН – СН3 Н2С – СН2 Н2С СН2 Циклобутан Метилциклопропан СН3
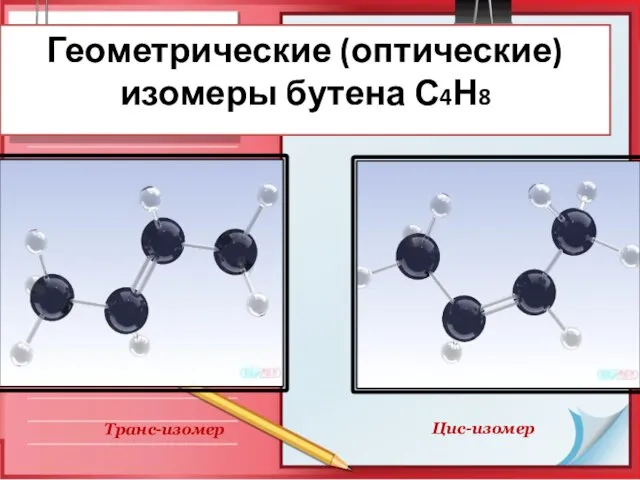
- 11. Геометрические (оптические) изомеры бутена С4Н8 Цис-изомер Транс-изомер
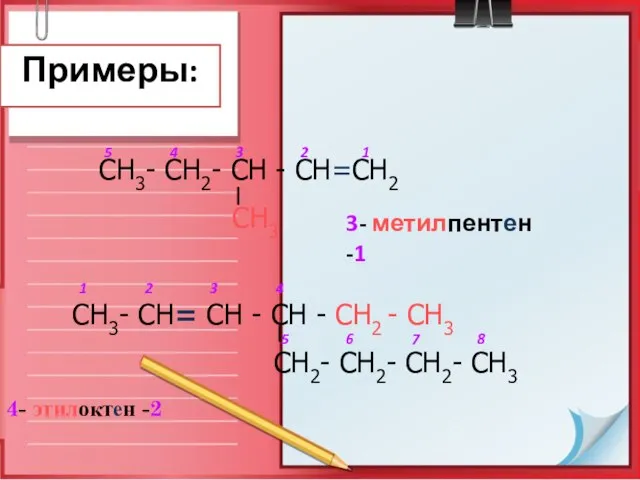
- 12. Примеры: 4- этилоктен -2 СН3- СН2- СН - СН=СН2 СН3 СН3- СН= СН - СН -
- 13. Физические свойства алкенов Алкены плохо растворимы в воде, но хорошо растворяются в органических растворителях. С увеличением
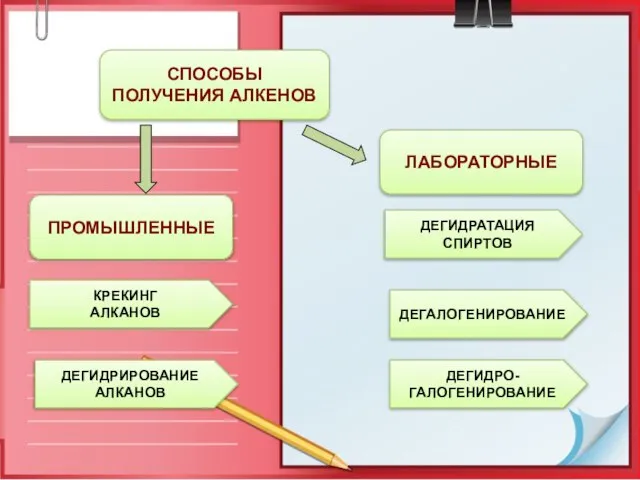
- 14. ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ ЛАБОРАТОРНЫЕ КРЕКИНГ АЛКАНОВ ДЕГИДРИРОВАНИЕ АЛКАНОВ ДЕГИДРАТАЦИЯ СПИРТОВ ДЕГАЛОГЕНИРОВАНИЕ ДЕГИДРО- ГАЛОГЕНИРОВАНИЕ
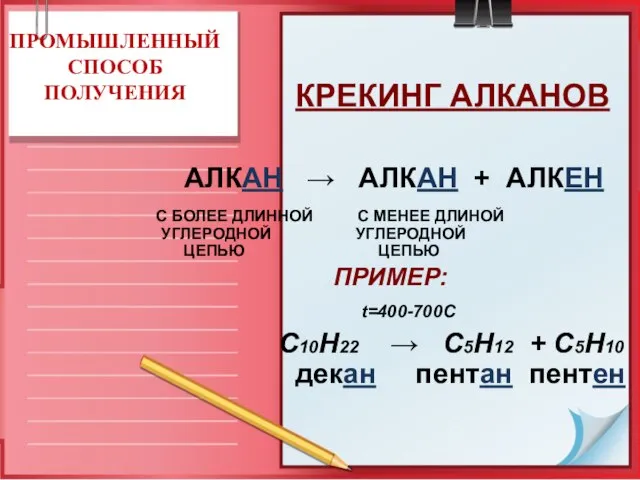
- 15. КРЕКИНГ АЛКАНОВ ПРИМЕР: t=400-700C С10Н22 → C5H12 + C5H10 декан пентан пентен ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ АЛКАН
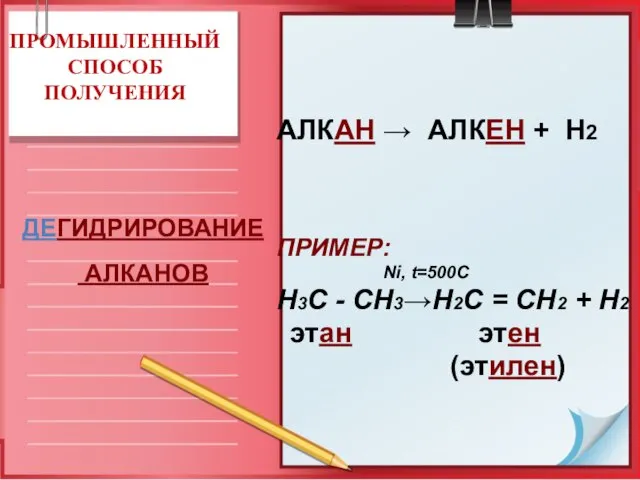
- 16. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ АЛКАН → АЛКЕН + Н2 ПРИМЕР: Ni, t=500C Н3С - СН3→Н2С = СН2
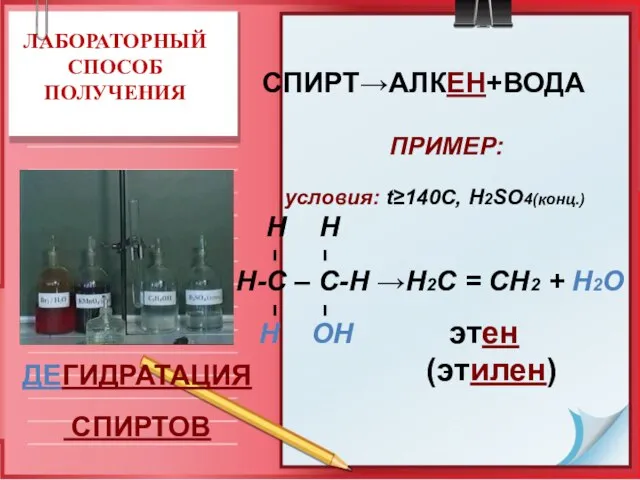
- 17. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ СПИРТ→АЛКЕН+ВОДА ПРИМЕР: условия: t≥140C, Н2SO4(конц.) Н Н Н-С – С-Н →Н2С = СН2
- 18. ЛАБОРАТОР-НЫЙ СПОСОБ ПОЛУЧЕНИЯ ПРИМЕР: t Н2С – СН2 + Zn → Н2С = СН2 + ZnBr2
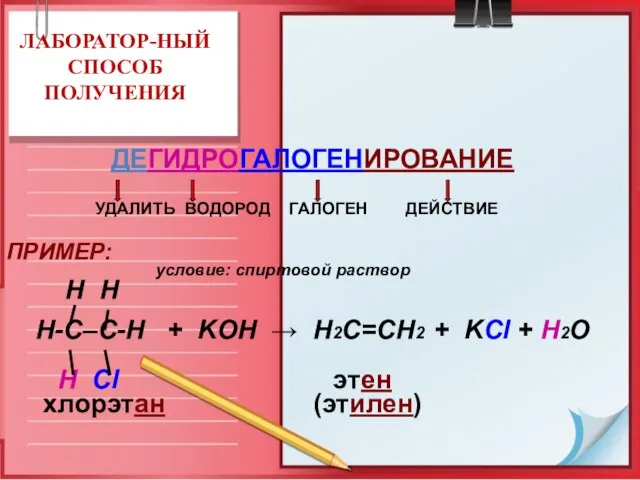
- 19. ЛАБОРАТОР-НЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРОГАЛОГЕНИРОВАНИЕ УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ ПРИМЕР: условие: спиртовой раствор H H Н-С–С-Н +
- 20. Механизм реакций присоедине-ния алкенов Электрофильное присоединение: разрыв π-связи протекает по гетеролитическому механизму, если атакующая частица является
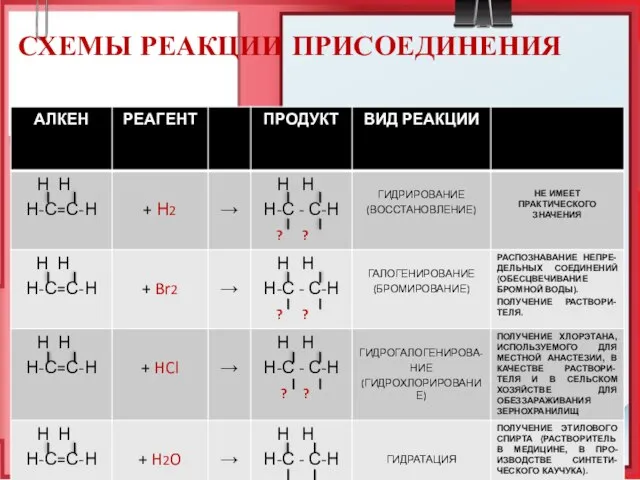
- 21. СХЕМЫ РЕАКЦИИ ПРИСОЕДИНЕНИЯ
- 22. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ Это процесс соединения одинаковых молекул в более крупные. ПРИМЕР: n CH2=CH2 (-CH2-CH2-)n этилен полиэтилен
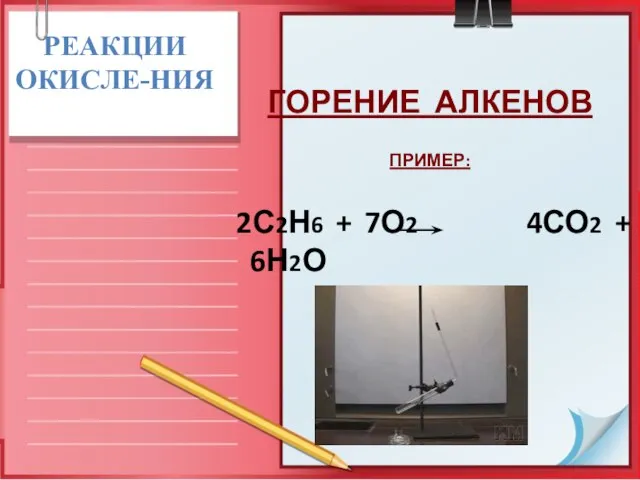
- 23. РЕАКЦИИ ОКИСЛЕ-НИЯ ГОРЕНИЕ АЛКЕНОВ ПРИМЕР: 2С2Н6 + 7О2 4СО2 + 6Н2О
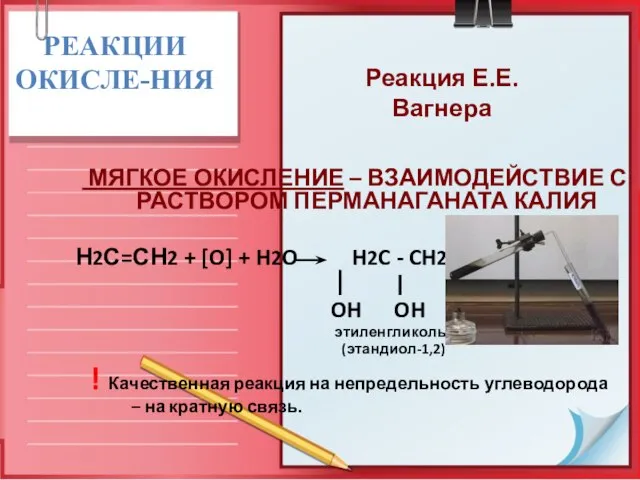
- 24. РЕАКЦИИ ОКИСЛЕ-НИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ Н2С=СН2 + [O] + H2O H2C
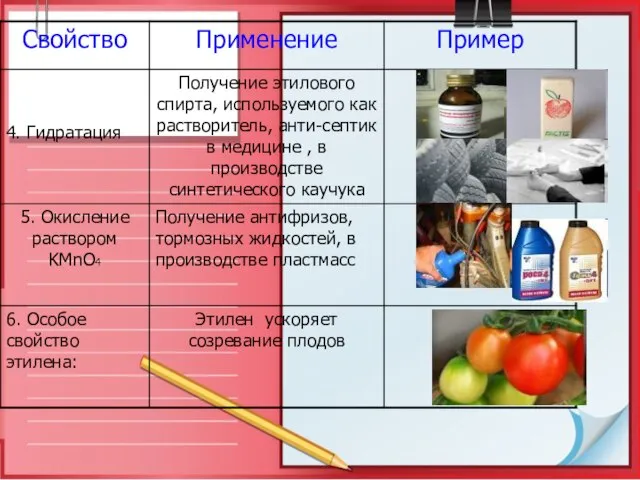
- 25. Применение этилена
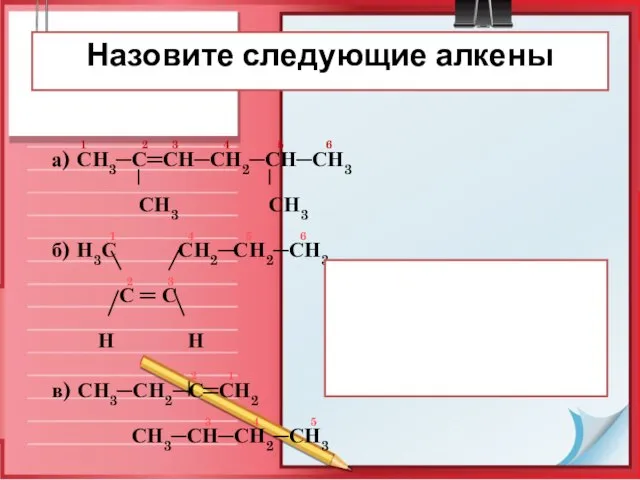
- 27. 1 2 3 4 5 6 а) СН3─С═СН─СН2─СН─СН3 СН3 СН3 1 4 5 6 б) Н3С
- 29. Скачать презентацию








 Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина Биоорганическая химия
Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина Биоорганическая химия Природные источники углеводородов
Природные источники углеводородов Азот в сельском хозяйстве
Азот в сельском хозяйстве Спирты. Классификация спиртов
Спирты. Классификация спиртов Альдегиды (номенклатура и изомерия)
Альдегиды (номенклатура и изомерия) восстановление карбонильных соединений, кетены, поликарбонилы
восстановление карбонильных соединений, кетены, поликарбонилы Серная кислота и для чего используется
Серная кислота и для чего используется Способы разделение смесей. 7 класс
Способы разделение смесей. 7 класс Обратимые и необратимые химические реакции. Химическое равновесие
Обратимые и необратимые химические реакции. Химическое равновесие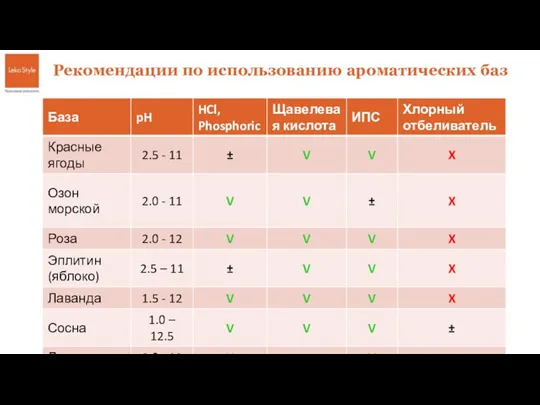 Базы для кислых и щелочных сред
Базы для кислых и щелочных сред Строение электронных оболочек атомов элементов малых периодов
Строение электронных оболочек атомов элементов малых периодов Биодизельное топливо
Биодизельное топливо Минералы алюминия
Минералы алюминия Чугуны
Чугуны Синтез-газ
Синтез-газ Гидролиз солей
Гидролиз солей Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Химическое равновесие в растворах электролитов
Химическое равновесие в растворах электролитов Здравствуйте, химия! Что изучает химия
Здравствуйте, химия! Что изучает химия Магматические породы
Магматические породы Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу
Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу Степени окисления
Степени окисления Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Спирты и фенолы. (Лекция 6.1)
Спирты и фенолы. (Лекция 6.1) Правила работы и хранения щелочных металлов. Утилизация остатков щелочных металлов
Правила работы и хранения щелочных металлов. Утилизация остатков щелочных металлов Слабые и сильные электролиты
Слабые и сильные электролиты Металлы. Химия. 11 класс
Металлы. Химия. 11 класс Аллотропные модификации
Аллотропные модификации