Слайд 2Под коррозией понимают разрушение (окисление) металлов и сплавов в результате взаимодействия их

с агрессивной окружающей средой.
- пр. окисления
Данный процесс протекает самопроизвольно (ΔG<0), причиной чего является термодинамическая неустойчивость металлов. Они переходят в более энергетически выгодное окисленное состояние.
Слайд 3 Факторы, вызывающие коррозию
1. Кислород и влага атмосферы;
2. Углекислый и сернистый газы,

содержащиеся в атмосфере;
3. Морская вода;
4. Грунтовые воды.
Слайд 4
В результате коррозии - металл окисляется, а окислитель окружающей среды

восстанавливается.
Окислителем чаще всего выступает , которые восстанавливаются.
- пр. восстановления
- пр. восстановления
Экономический ущерб от коррозии значителен. Специалисты подсчитали, что на Земле за одну секунду разрушается вследствие коррозии 1,5 т металлов. Велики также затраты на антикоррозионные мероприятия.
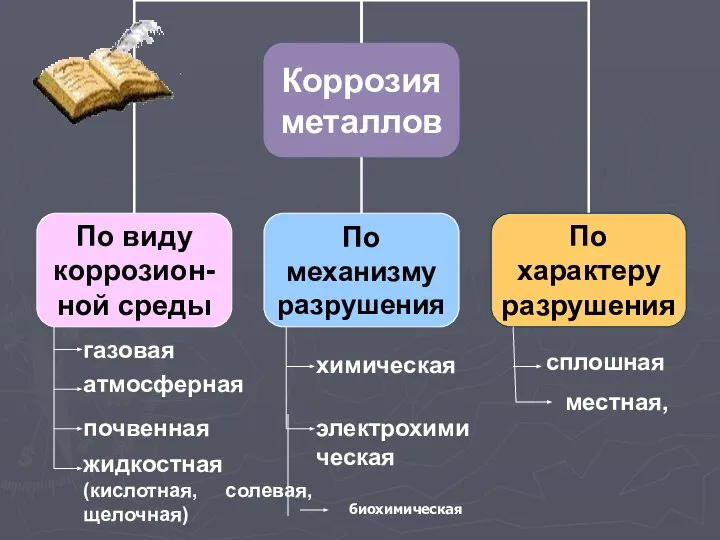
Слайд 5газовая
атмосферная
почвенная
жидкостная (кислотная, солевая, щелочная)
химическая
электрохимическая
сплошная
местная,
биохимическая
Слайд 6Сплошную делят на: равномерную, неравномерную и избирательную
(менее опасную)
Местную делят на:
очаговую,
пятнистую,
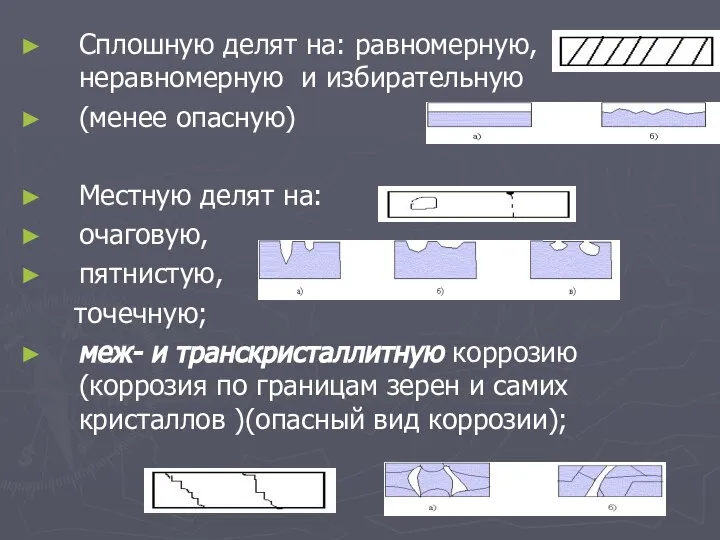
точечную;
меж- и транскристаллитную коррозию (коррозия по границам зерен и самих кристаллов )(опасный вид коррозии);
Слайд 7Биохимическая коррозия
Биокоррозия вызывается деятельностью различных микроорганизмов, использующих металл как питательную среду. Примером

такой коррозии может служить почвенная коррозия и коррозия в застойных водах.
Слайд 8Химическая коррозия
- это разрушение МЕ под действием сухих агрессивных газов при высокой

температуре ( ) – газовая коррозия, которая исключает следы влаги на поверхности, а также под действием жидких неэлектролитов – жидкостная коррозия, т.е. веществ не проводящих электрический ток (нефть и продукты ее переработки).
Слайд 9Химической коррозии подвергаются:
узлы и детали двигателя внутреннего сгорания, газовых турбин и т.д..
В

случае, если окислителем является кислород, то образуются оксиды металлов:
Слайд 10Химическая коррозия
Если продукты такого взаимодействия нелетучи и образуют плотную пленку (например: на

Al), то коррозия со временем уменьшается.
Если образуется рыхлая пленка (например: на Fe), то коррозия может привести к полному разрушению металла.
Этот вид коррозии протекает в основном равномерно по всей поверхности металла. В связи с этим химическая коррозия менее опасна, чем электрохимическая.
Слайд 11Электрохимическая коррозия
Это наиболее распространенный вид коррозии, приносящий наибольший вред металлам и изделиям

из них.
Электрохимическая коррозия возникает при контакте двух или более металлов одного сплава или металла с поверхностью изделия из другого металла в присутствии воды или другого электролита (веществ проводящих электрический ток). Механизм электрохимической коррозии связан с работой ГЭ.
Слайд 12На поверхности Ме и сплавов образуется множество микрогальванопар. Участок с меньшим значением

потенциала служит анодом, а участок с большим значением потенциала служит катодом.
При возникновении микрогальванопары сила возникающего электрического тока тем больше, чем дальше друг от друга стоят контактирующие металлы в ряду напряжения.
Слайд 13При этом поток (е-) от более активного металла идет к металлу менее

активному. Окислительно-восстановительный процесс в отличии от химической коррозии протекает на различных участках поверхности. Анодный участок поверхности (окисляется), а на катоде восстанавливается окислитель из окружающей среды.
Слайд 14На поверхности катода в зависимости от условий (кислая, щелочная или нейтральная среда)

происходит восстановление
или
Водородной деполяризации подвергаются Ме, находящиеся в ряду активности от начала ряда Li …. до ...Cd, т.к. Е( ) = -0,42 B (в нейтральной среде рН=7), а Е(Cd) = -0,41 В, однако реально Zn, Cr, Al на своей поверхности имеют прочную оксидную пленку, которая не позволяет им растворяться в воде.
Слайд 15Кислородной деполяризации подвергаются Ме стоящие в ряду активности от Cd…..Ag
Е(Ag) =

+0,8 В, кислород в кислой среде очень опасен, т.к. охватывает более широкий интервал металла.
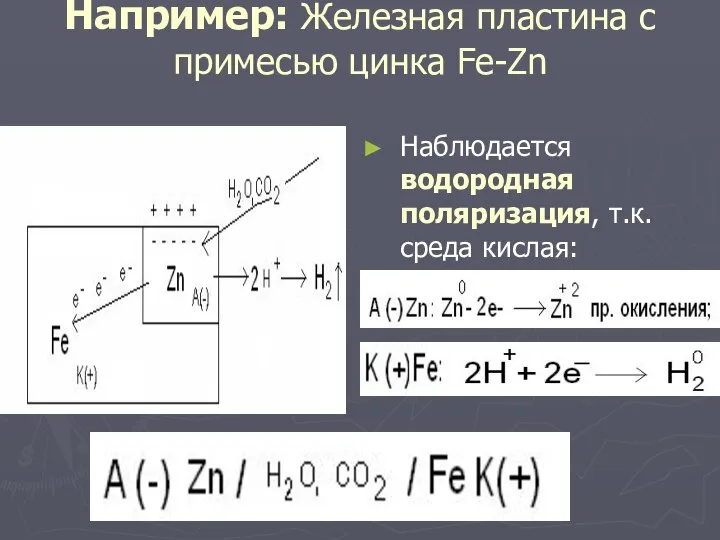
Слайд 16Например: Железная пластина с примесью цинка Fe-Zn
Наблюдается водородная поляризация, т.к. среда кислая:
Слайд 17НАПРИМЕР: Железная пластина с примесью никеля
При контакте двух металлов в электропроводящей среде
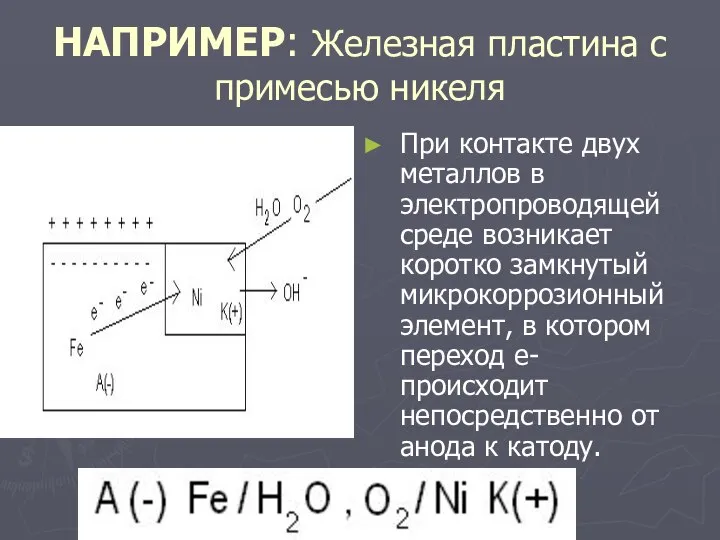
возникает коротко замкнутый микрокоррозионный элемент, в котором переход е- происходит непосредственно от анода к катоду.
Слайд 18Электрохимические процессы:
В процессе реакции железо будет растворяться:
а на никеле идет восстановление окружающей

среды:
Суммарное уравнение запишется в виде:
Слайд 19Электрохимическая коррозия имеет большую скорость, чем химическая коррозия.
ПРИЧИНЫ ВОЗНИКНОВЕНИЯ КОРРОЗИИ:
1. энергетическая неоднородность

поверхности Ме;
2. неоднородность химического и фазового состава;
3. наличие примесей в Ме;
4. характер поверхности (шероховатость, излом);
5. наличие дефектов кристаллической решетки Ме;
6. неодинаковая концентрация окислителя на различных участках поверхности Ме.
Слайд 20Скорость коррозии определяется:
1. по глубинному показателю (в потере толщины Ме в год);
2.

по массовому показателю (потеря массы Ме в ед. времени).
ФАКТОРЫ ВЛИЯЮЩИЕ НА СКОРОСТЬ:
1. внутренние (природа Ме, наличие примесей, дефектов кристаллической решетки Ме);
2. внешние (рН раствора, окружающая среда, температура).
Слайд 23Для достижения лучшей устойчивости коррозии важны такие факторы, как:
Грамотный дизайн автомобиля, позволяющий

избегать «лишних» соединений и прямого попадания реагентов и дорожной грязи в сварные соединения и скрытые полости.
Дополнительное покрытие металла. Более толстое покрытие (краска, оцинковка, антикор) дает более сильную защиту от коррозии. Использование грунтовок с хорошим прилипанием к металлу и хорошим проникновением в щели.
Обязательное применение антикоррозионных препаратов с высокой проникающей способностью для обработки соединений и деталей, обеспечивающих защиту деталей от влажности и дорожной грязи. Обязательная обработка антикоррозионными материалами с большим содержанием ингибиторов коррозии (активных соединений, останавливающих и предотвращающих коррозию).
Ржавеет даже оцинкованный автомобиль. Слой оцинковки имеет свойство (с течением времени) истончаться и разрушаться и подвергаться активным атакам коррозии.
Для автомобиля важно применение различных средств защиты (комбинирование).
Коррозию можно остановить и победить!!!






















 Көмірдің оптикалық қасиеттері
Көмірдің оптикалық қасиеттері Prezentatsia_lektsia_Reaktora_1_Klassifikatsia
Prezentatsia_lektsia_Reaktora_1_Klassifikatsia Презентация на тему Руды металлов
Презентация на тему Руды металлов  Углеводороды
Углеводороды Неметаллы
Неметаллы Карбоновые кислоты
Карбоновые кислоты Соли, их классификация и свойства
Соли, их классификация и свойства Знакомый и незнакомый углерод (9 класс)
Знакомый и незнакомый углерод (9 класс) Строение атома. Химическая связь
Строение атома. Химическая связь Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры)
Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры) АЛКИНЫ (ацетиленовые углеводороды)
АЛКИНЫ (ацетиленовые углеводороды) Презентация на тему Подгруппа кислорода
Презентация на тему Подгруппа кислорода  Презентация на тему Окислительно-восстановительные реакции
Презентация на тему Окислительно-восстановительные реакции  Замедленное коксование нефтяного сырья
Замедленное коксование нефтяного сырья Презентация по Химии "Использование исследовательских и информационно-коммуникационных технологий в обучении химии" - скача
Презентация по Химии "Использование исследовательских и информационно-коммуникационных технологий в обучении химии" - скача Презентация на тему История семи великих камней Алмазного фонда России
Презентация на тему История семи великих камней Алмазного фонда России  Поляризуемость. Эллипсоид поляризуемости и симметрия молекулы
Поляризуемость. Эллипсоид поляризуемости и симметрия молекулы Основы химии полимеров
Основы химии полимеров Приложения для отслеживания проб ALS Geochemistry
Приложения для отслеживания проб ALS Geochemistry Спирт и его влияние на организм человека
Спирт и его влияние на организм человека Порох. Сера, халькогены
Порох. Сера, халькогены Химическое равновесие
Химическое равновесие Презентация на тему ОВР в органической химии
Презентация на тему ОВР в органической химии  Производство серной кислоты
Производство серной кислоты Химическое кафе «Кислоты»
Химическое кафе «Кислоты» Элементарный, химический и фракционный состав нефти, газа и конденсата
Элементарный, химический и фракционный состав нефти, газа и конденсата Пищевые кислоты
Пищевые кислоты Валентность и АМУ
Валентность и АМУ