Слайд 13Степень окисления –
Это условный заряд атомов химического элемента в соединении, вычисленный

на основе предположения, что все соединения (и ионные и ковалентно-полярные) состоят только из ионов.
Слайд 14Правила определения степени окисления:
Степень окисления свободных атомов и простых веществ равна 0:

( Mg0, N20, K0)
Степень окисления водорода в соединениях с неметаллами равна +1, а с металлами равна -1: (NaH-1, H+1Cl).
Степень окисления фтора в соединениях всегда равна -1: (HF-1, CaF-12).
Степень окисления кислорода в соединениях равна -2 (NO-2, Al2O3-2), а в пероксидах -1 (H2O2-1) в соединении с фтором +2 (O+2F2)
Степень окисления металлов в соединениях всегда положительная , у металлов I-A, II-A, III-A соответственно равна +1, +2, +3 .
Суммарная степень окисления всех атомов в молекуле равна 0.
Высшая степень окисления элемента равна (+№ группы).
Низшая степень окисления: для металлов равна 0, для неметаллов равна (№ группы -8).
Слайд 15Промежуточные с.о.
Рассмотрим возможные с.о. серы – S
Максимальная +6 SO3
Минимальная -2 H2S
Сера может

проявлять с.о. 0,+2,+4 – это промежуточные с.о.
Слайд 16Как определить степень окисления элемента в соединении? (с. 88)
1) Определение степеней окисления

начинают с того элемента, у которого С.О. (Р2О-25); постоянная или известна в соответствии с правилами (см. выше);
2) Умножить эту С.О. на индекс (– 2 * 5 = – 10);
3) Полученное число разделить на индекс второго элемента (– 10 / 2 = – 5);
Записать полученную С.О. с противоположным знаком (Р+52О-25).
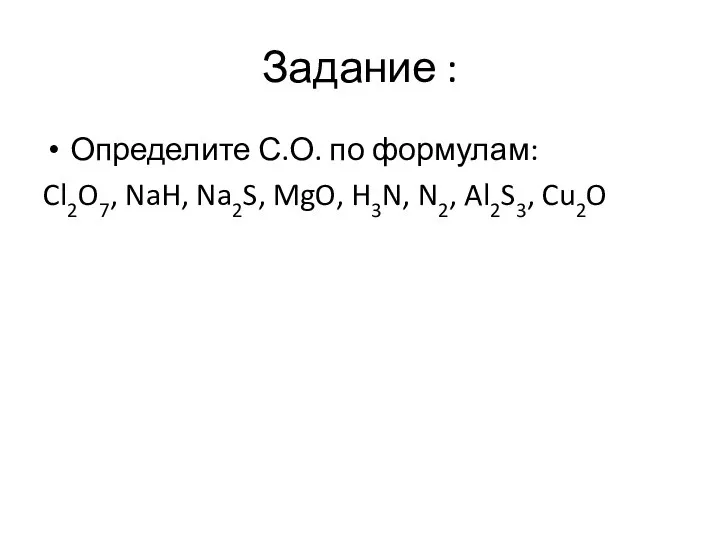
Слайд 17Задание :
Определите С.О. по формулам:
Cl2O7, NaH, Na2S, MgO, H3N, N2, Al2S3, Cu2O
Слайд 18Алгоритм названия бинарных соединений:
Пример: Al+32O-23 – оксид алюминия; Cu+2O-2 – оксид меди (II)
Cl-1 –

хлорид; O-2 – оксид; Н-1 – гидрид;
S-2 – сульфид; C-4 – карбид; N-3 – нитрид; P-3 — фосфид; Si-4 — силицид.
Слайд 19Алгоритм составления формул по названиям:
Записать знаки элементов (частиц) в порядке: на первом

месте – положительно заряженную, на втором – отрицательно заряженную ( Al O );
Расставить степени окисления ( Al+3 O-2);
Найти наименьшее общее кратное (НОК) между значениями степеней окисления, записать его между ними в “окошечко”;
Разделить НОК на значение степеней окисления, полученные результаты записать как индексы (6/3=2; 6/3=3 Al2O3).









 Окислительновосстановительные индикаторы. Задача 12 Команда: Мастера Беспорядка
Окислительновосстановительные индикаторы. Задача 12 Команда: Мастера Беспорядка Химические формулы
Химические формулы Презентация на тему Теория строения органических соединений А.М. Бутлерова
Презентация на тему Теория строения органических соединений А.М. Бутлерова  Химия элементов (лекция 5)
Химия элементов (лекция 5) Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи
Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи Презентация на тему Химия в повседневной жизни человека
Презентация на тему Химия в повседневной жизни человека  Строение углеводородов
Строение углеводородов Презентация на тему Фосфор
Презентация на тему Фосфор  Полимеры
Полимеры Презентация по Химии "Конструкции из стекла"
Презентация по Химии "Конструкции из стекла"  Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории
Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории Виды работ на уроках химии
Виды работ на уроках химии Каких заданий не бывает на ЕГЭ по химии и почему
Каких заданий не бывает на ЕГЭ по химии и почему Изменения в составе ядра атома Задачи урока: Познакомиться с понятием «ядерные процессы», «изотопы» Развить понятие «Химически
Изменения в составе ядра атома Задачи урока: Познакомиться с понятием «ядерные процессы», «изотопы» Развить понятие «Химически Электролитическая диссоциация
Электролитическая диссоциация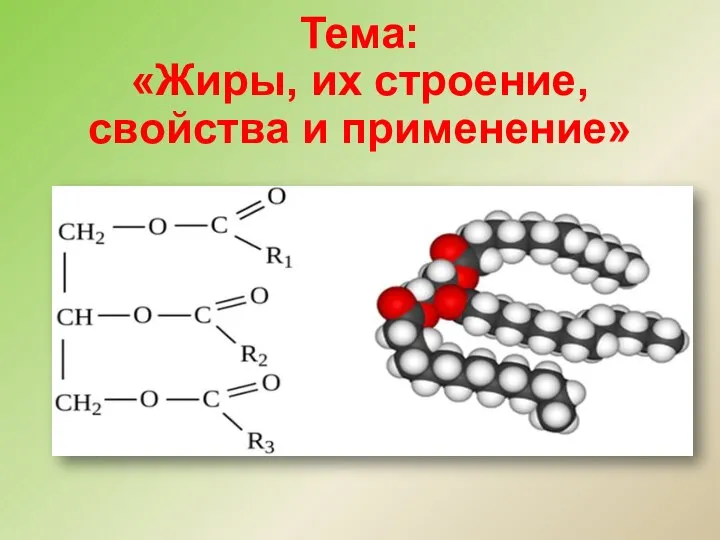 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Вода. Строение молекулы воды. Анализ и синтез воды
Вода. Строение молекулы воды. Анализ и синтез воды Комплексонометрическое титрование. Часть 2. Лекция 6
Комплексонометрическое титрование. Часть 2. Лекция 6 Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Химическая викторина
Химическая викторина Строение вещества. Химическая связь
Строение вещества. Химическая связь Электролиз и его применение
Электролиз и его применение Классификация углеводов: моносахариды, дисахариды, полисахариды. Химическая структура. Свойства и функция углеводов
Классификация углеводов: моносахариды, дисахариды, полисахариды. Химическая структура. Свойства и функция углеводов Презентация на тему Альдегиды
Презентация на тему Альдегиды  Химия природная или синтетическая. За и против
Химия природная или синтетическая. За и против Основные полимеры, используемые для производства электроизоляционных материалов и пропиточных составов
Основные полимеры, используемые для производства электроизоляционных материалов и пропиточных составов Химические свойства кислот. 11 класс
Химические свойства кислот. 11 класс