Содержание
- 2. ГОМОЛОГИЧЕСКИЙ РЯД АЛКЕНОВ
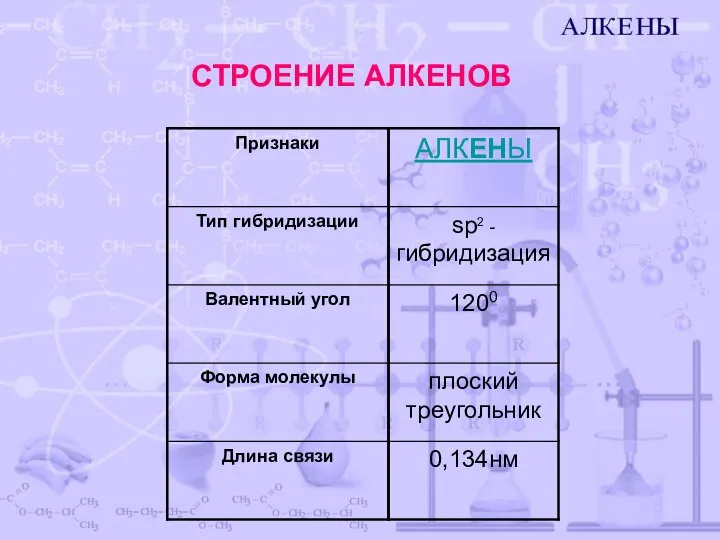
- 3. СТРОЕНИЕ АЛКЕНОВ
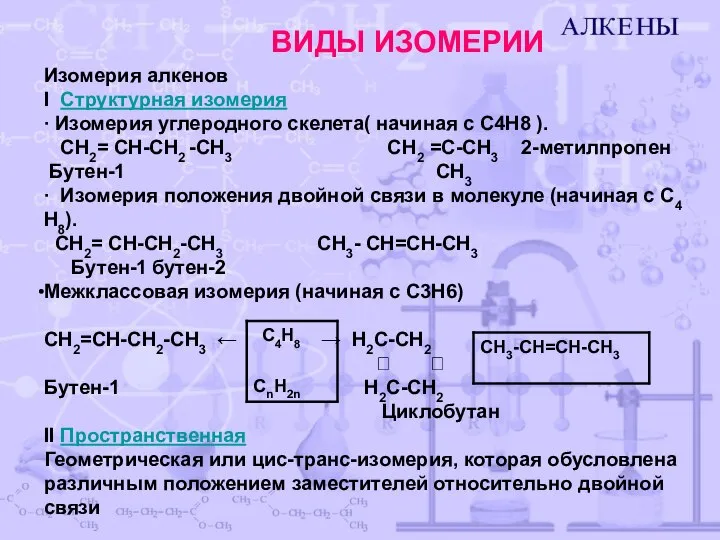
- 4. Изомерия алкенов Ι Структурная изомерия ∙ Изомерия углеродного скелета( начиная с C4H8 ). CH2= CH-CH2 -CH3
- 5. Алкены имеют молекулярную кристаллическую решетку С1 -С4- бесцветные газы С5-С17-бесцветные жидкости С18-твердые вещества Физические свойства алкенов
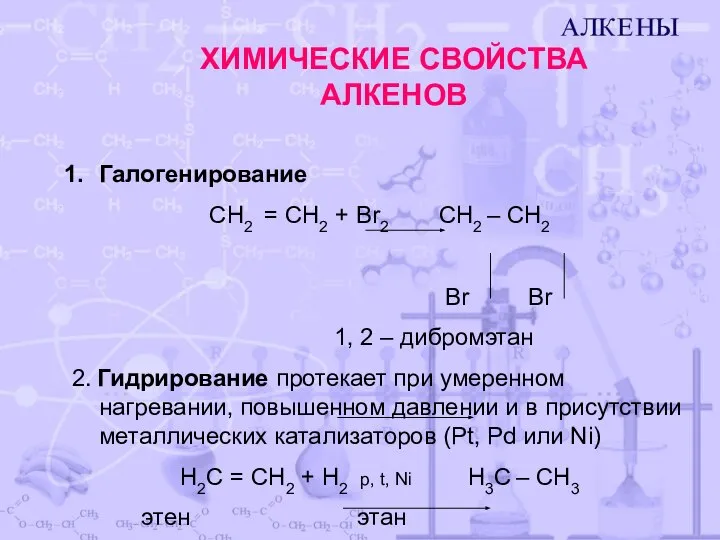
- 6. ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ Галогенирование CH2 = CH2 + Br2 CH2 – CH2 Br Br 1, 2
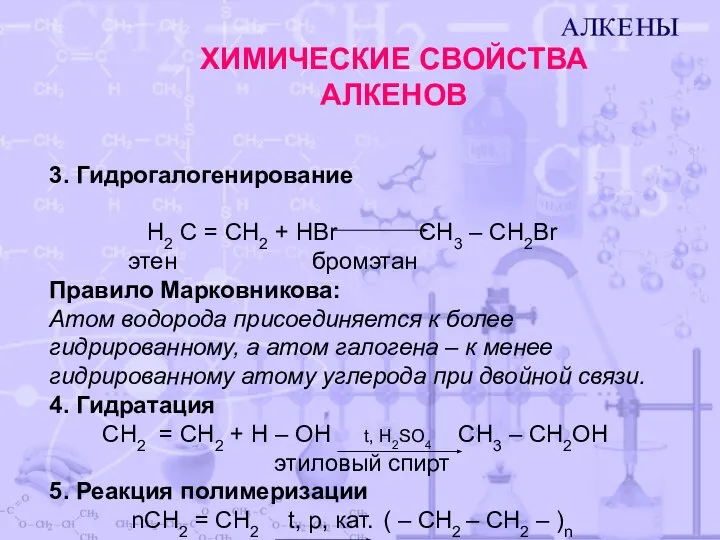
- 7. ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ 3. Гидрогалогенирование H2 С = CH2 + НBr CH3 – CH2Br этен бромэтан
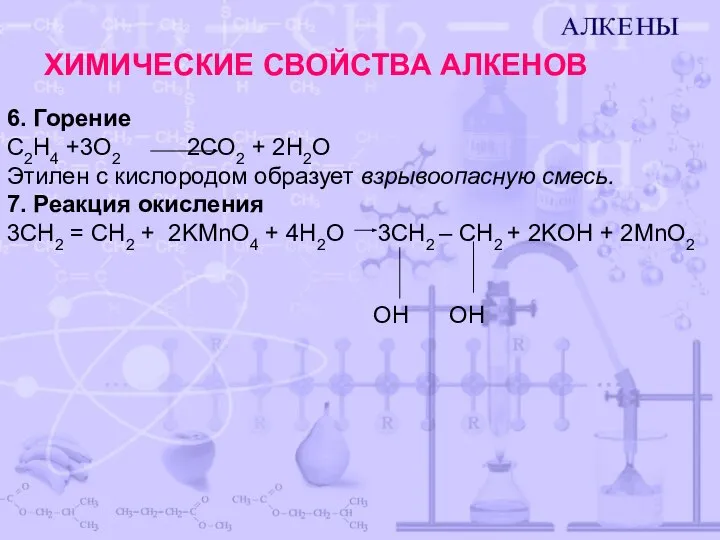
- 8. 6. Горение C2H4 +3O2 2CO2 + 2H2O Этилен с кислородом образует взрывоопасную смесь. 7. Реакция окисления
- 9. ПОЛУЧЕНИЕ АЛКЕНОВ 1)Крекинг нефтепродуктов. C16H34 C8H18+C8H16 гексадекан октан октен 2)Дегидрирование предельных углеводов. CH2=CH-CH2-CH3+H2 CH3-CH2-CH2-CH3 бутен-1 CH3-CH=CH-CH3+H2
- 10. Получение этена (этилена) в лабораторных условиях. В пробирку поместили 6 мл 96% концентрированной серной кислоты, 3мл
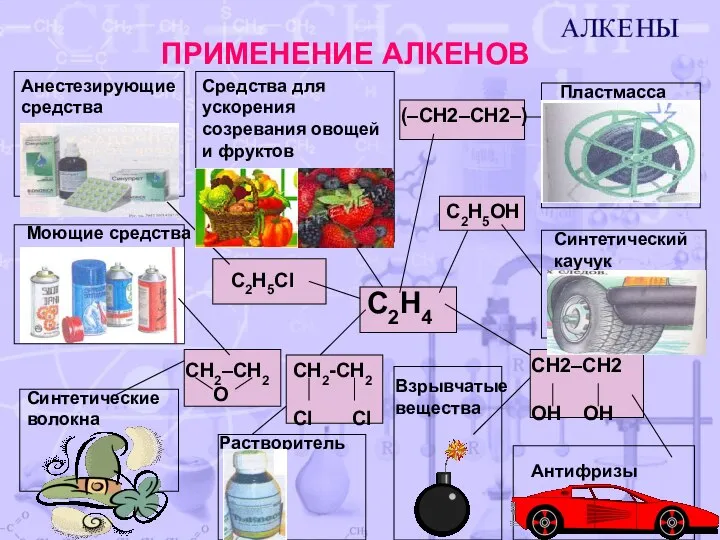
- 11. ПРИМЕНЕНИЕ АЛКЕНОВ Анестезирующие средства Моющие средства Синтетические волокна Средства для ускорения созревания овощей и фруктов (–CH2–CH2–)
- 13. Скачать презентацию




 Карбоновые кислоты
Карбоновые кислоты Водород
Водород Вода и классы химических веществ
Вода и классы химических веществ Химическая технология. Структура ВКР
Химическая технология. Структура ВКР Химический состав клетки. Неорганические вещества
Химический состав клетки. Неорганические вещества Классификация НПВС (по химической структуре активности)
Классификация НПВС (по химической структуре активности) Технические материалы. Металлические и неметаллические. (Тема 1)
Технические материалы. Металлические и неметаллические. (Тема 1) Презентация на тему Круговорот углерода в природе
Презентация на тему Круговорот углерода в природе  Нефть
Нефть Турнир знатоков химии. Химическая лихорадка
Турнир знатоков химии. Химическая лихорадка VI A Grupas elementi
VI A Grupas elementi Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Взаимодействие металлов с водой, щелочами, кислотами, солями, простыми веществами
Взаимодействие металлов с водой, щелочами, кислотами, солями, простыми веществами Химическое расследование. Химические свойства галогенов
Химическое расследование. Химические свойства галогенов Астат. Свойства астата
Астат. Свойства астата Спирты. Классификация
Спирты. Классификация Алкены-3
Алкены-3 Металлы общая характеристика
Металлы общая характеристика Положение об осуществлении контроля за внешнеэкономической деятельностью в отношении химикатов, оборудования и технологий
Положение об осуществлении контроля за внешнеэкономической деятельностью в отношении химикатов, оборудования и технологий електроліти та неелектроліти
електроліти та неелектроліти Элементарный химический состав белков
Элементарный химический состав белков Натуральный каучук
Натуральный каучук Углерод
Углерод 01. Химический состав
01. Химический состав Презентация на тему Типы химических реакций
Презентация на тему Типы химических реакций  Презентация по химии. Спирты, их свойства и применение.
Презентация по химии. Спирты, их свойства и применение. Презентация на тему Гидролиз солей
Презентация на тему Гидролиз солей  Химическое равновесие
Химическое равновесие