Содержание
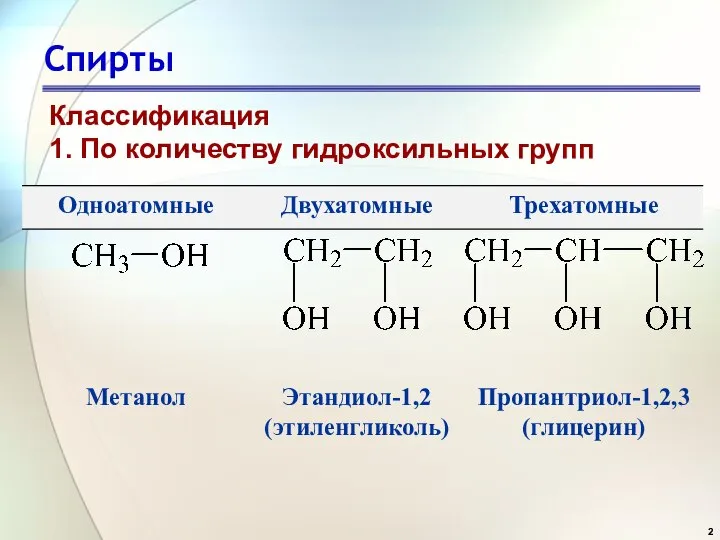
- 2. Спирты Классификация 1. По количеству гидроксильных групп
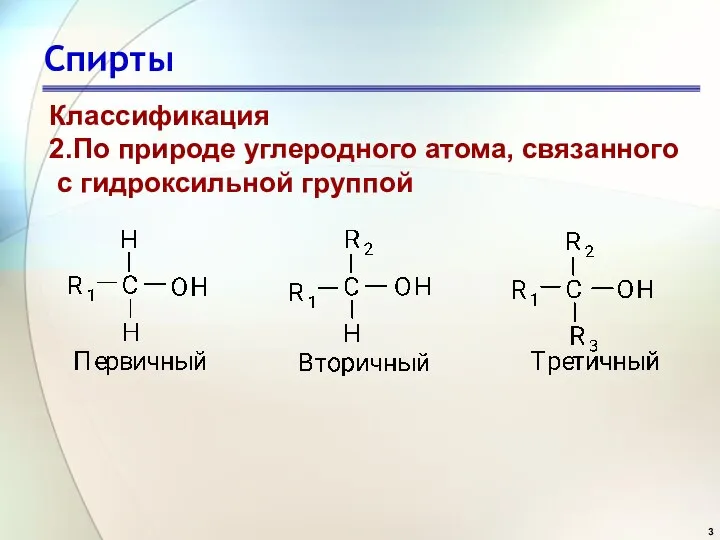
- 3. Спирты Классификация 2.По природе углеродного атома, связанного с гидроксильной группой
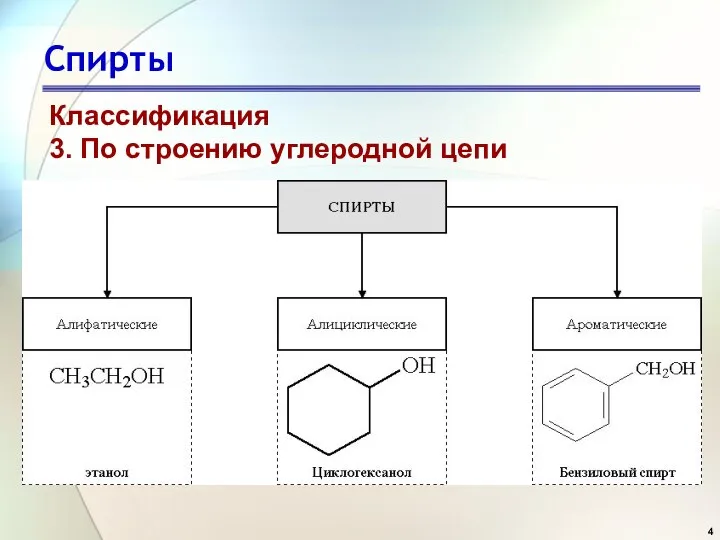
- 4. Спирты Классификация 3. По строению углеродной цепи
- 5. Спирты Изомерия 1. Измерия положения гидроксильной группы Пропанол-1 (н-пропиловый спирт) Пропанол-2 (изопропиловый спирт)
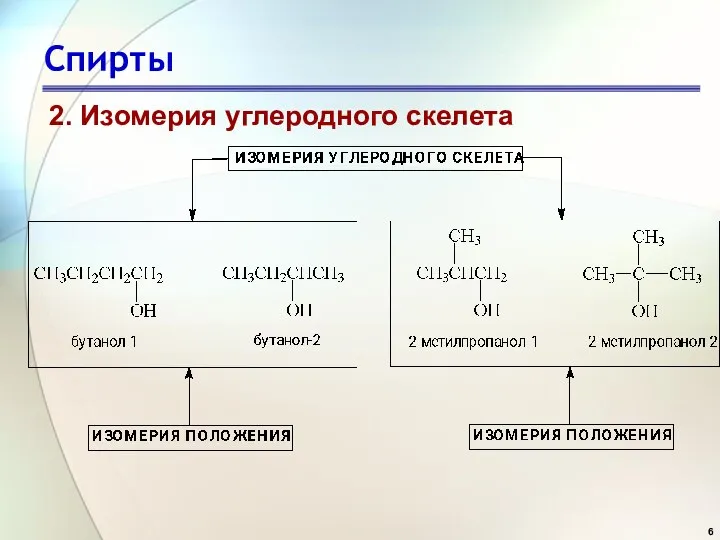
- 6. Спирты 2. Изомерия углеродного скелета
- 7. Спирты Номенклатура 1.Рациональная номенклатура 2.Радикально-функциональная номенклатура 3.Заместительная номенклатура
- 8. Спирты Номенклатура 1.По рациональной номенклатуре спирты называют как производные метанола (называется карбинол), у которого один или
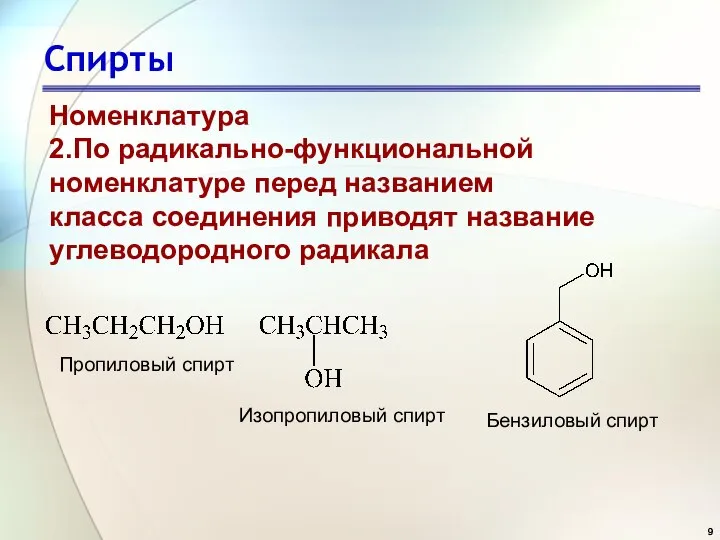
- 9. Спирты Номенклатура 2.По радикально-функциональной номенклатуре перед названием класса соединения приводят название углеводородного радикала Изопропиловый спирт Пропиловый
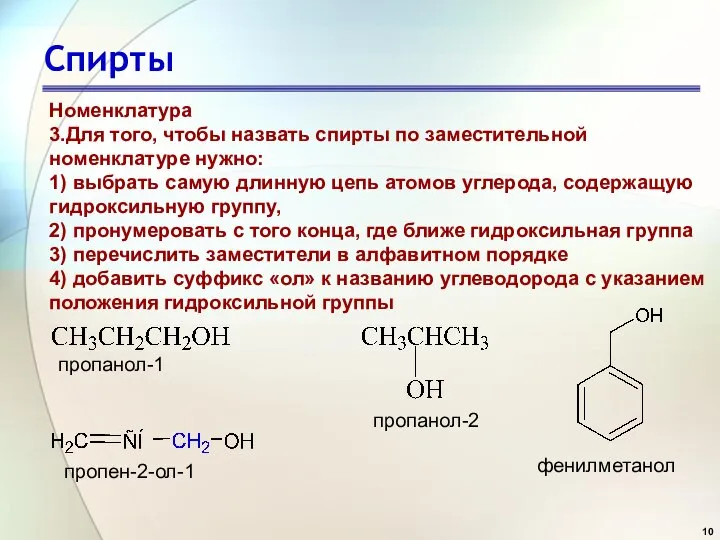
- 10. Спирты Номенклатура 3.Для того, чтобы назвать спирты по заместительной номенклатуре нужно: 1) выбрать самую длинную цепь
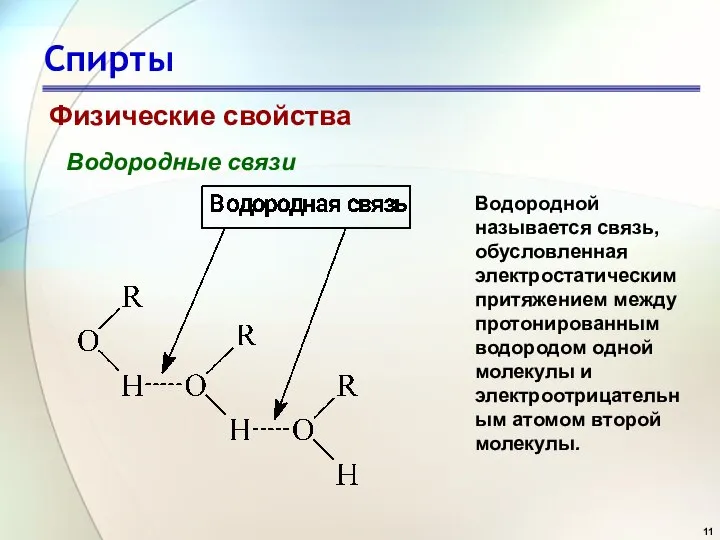
- 11. Спирты Физические свойства Водородные связи Водородной называется связь, обусловленная электростатическим притяжением между протонированным водородом одной молекулы
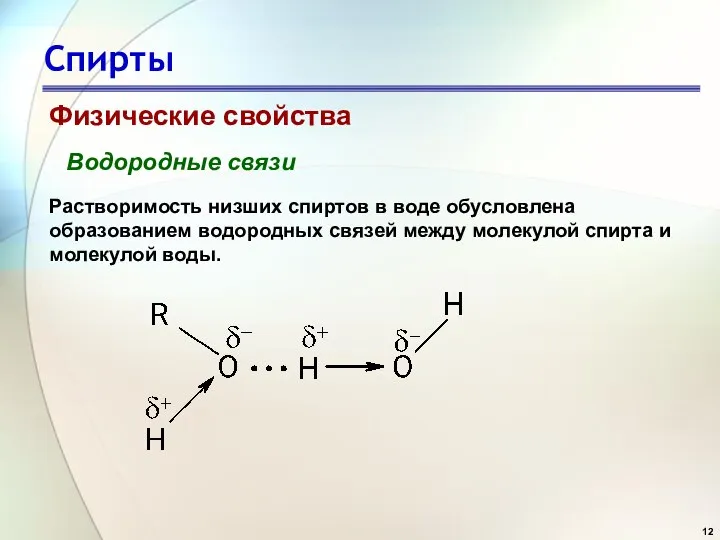
- 12. Спирты Физические свойства Водородные связи Растворимость низших спиртов в воде обусловлена образованием водородных связей между молекулой
- 13. Спирты Способы получения 1. Гидратация алкенов (промышленный метод) Присоединение воды к алкенам происходит в присутствии кислых
- 14. Спирты Способы получения 2. Брожение сахаров Дрожжи сбраживают некоторые виды сахаров. Это сложный каталитический многостадийный распад
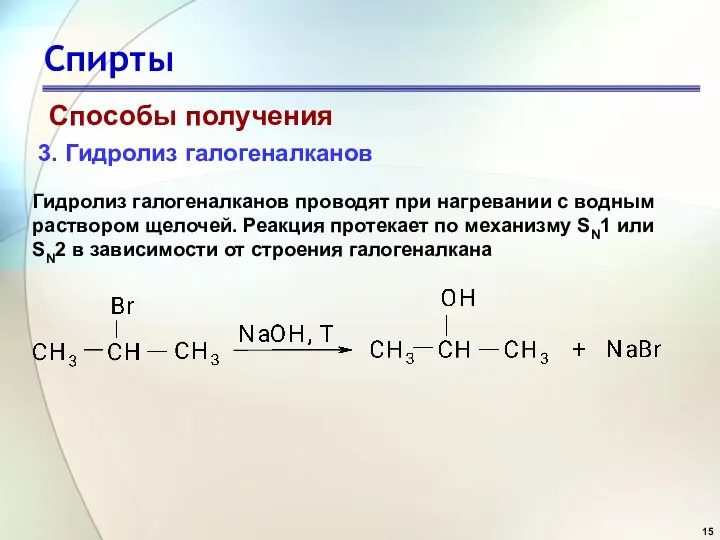
- 15. Спирты Способы получения 3. Гидролиз галогеналканов Гидролиз галогеналканов проводят при нагревании с водным раствором щелочей. Реакция
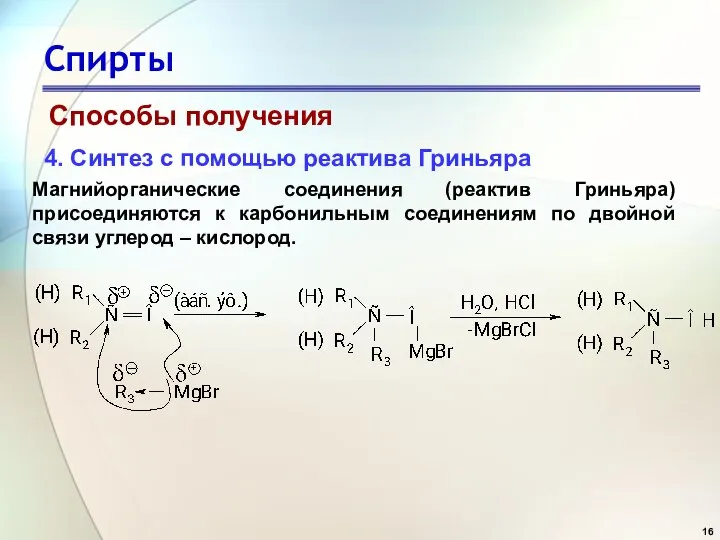
- 16. Спирты Способы получения 4. Синтез с помощью реактива Гриньяра Магнийорганические соединения (реактив Гриньяра) присоединяются к карбонильным
- 17. Спирты Способы получения 4. Синтез с помощью реактива Гриньяра Для синтеза первичных спиртов используют в качестве
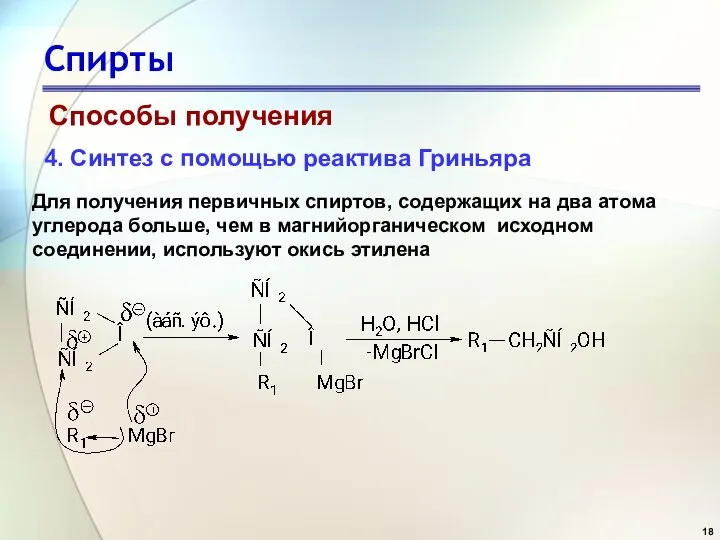
- 18. Спирты Способы получения 4. Синтез с помощью реактива Гриньяра Для получения первичных спиртов, содержащих на два
- 19. Спирты Способы получения 5. Гидроборирование-окисление алкенов Алкены взаимодействуют с дибораном В2Н6 с образованием алкилборана. Диборан -
- 20. Спирты Способы получения 6. Восстановление карбонильных соединений Альдегиды восстанавливаются в первичные спирты, кетоны – во вторичные
- 21. Спирты Способы получения 6. Восстановление карбонильных соединений Литийалюминийгидрид LiAlН4 – удобный, но дорогой восстанавливающий агент, используют
- 22. Спирты Способы получения 7. Восстановление сложных эфиров Первичные спирты также могут быть получены восстановлением сложного эфира,
- 23. Спирты Химические свойства 1. Кислотность спиртов В молекуле спирта содержится атом водорода, связанный с сильно электроотрицательным
- 24. Спирты Химические свойства 1. Кислотность спиртов
- 25. Спирты Химические свойства 1. Кислотность спиртов Алкоксиды (алкоголяты) нельзя получить реакцией спирта с гидроксидами металлов, их
- 26. Спирты Кислотность спиртов Кислотность спиртов в водных растворах pKa=-lgKa
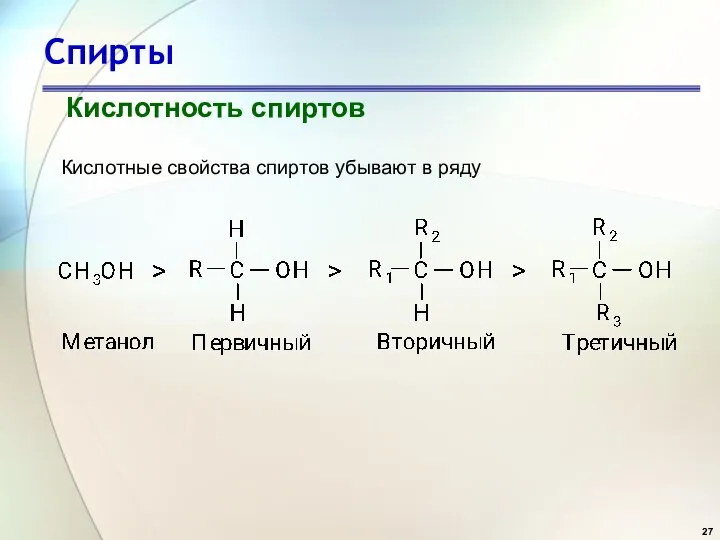
- 27. Спирты Кислотность спиртов Кислотные свойства спиртов убывают в ряду
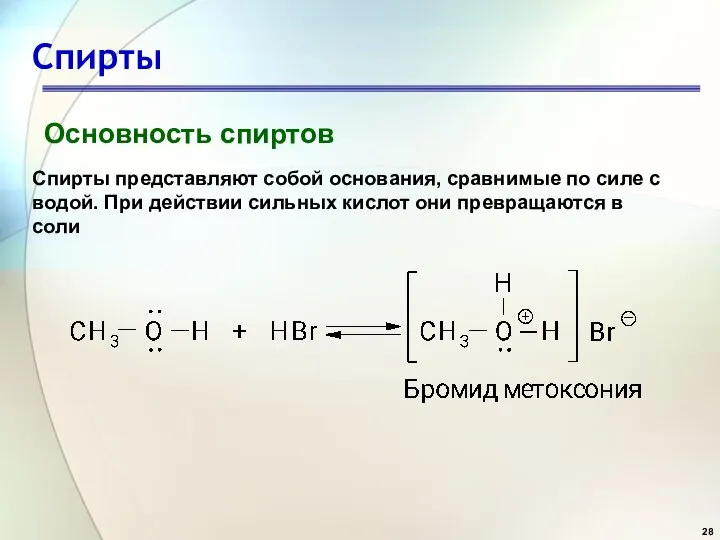
- 28. Спирты Основность спиртов Спирты представляют собой основания, сравнимые по силе с водой. При действии сильных кислот
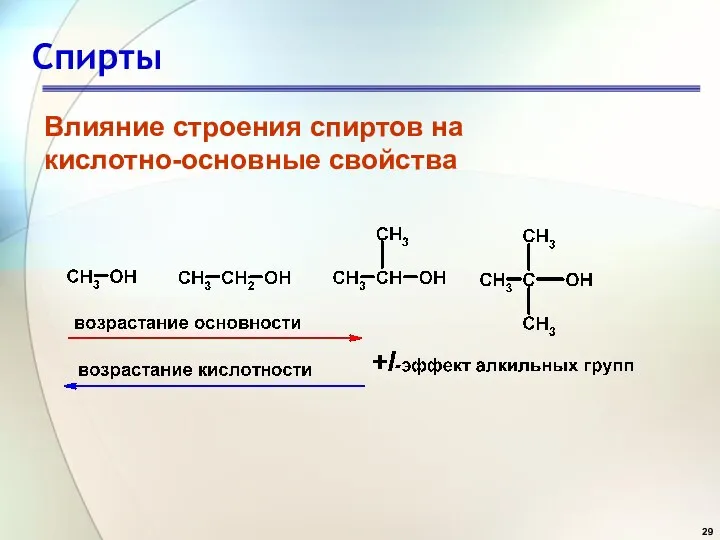
- 29. Спирты Влияние строения спиртов на кислотно-основные свойства
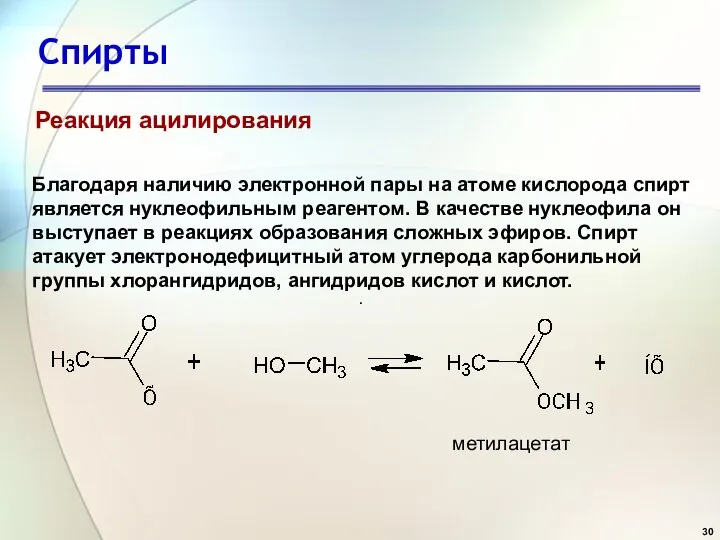
- 30. Спирты . Реакция ацилирования Благодаря наличию электронной пары на атоме кислорода спирт является нуклеофильным реагентом. В
- 31. Спирты . Реакция ацилирования С карбоновыми кислотами спирты реагируют в присутствии кислотных катализаторов, которые увеличивают поляризацию,
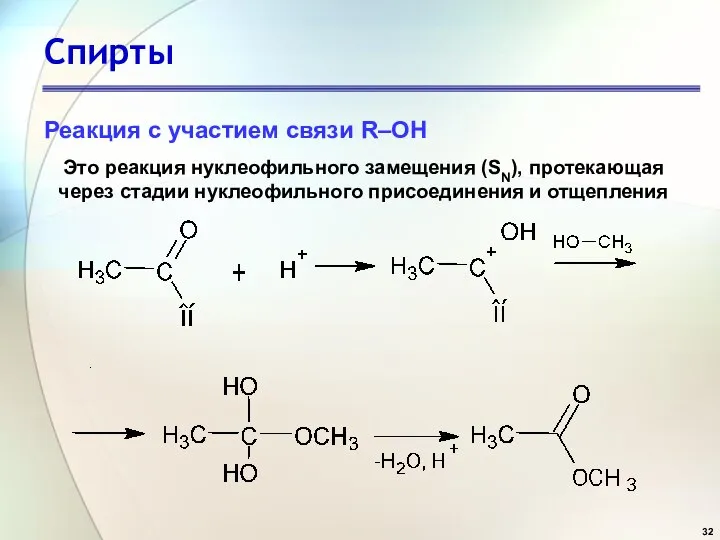
- 32. Спирты Реакция с участием связи R–OH . Это реакция нуклеофильного замещения (SN), протекающая через стадии нуклеофильного
- 33. Спирты Реакции нуклеофильного замещения Реакции с галогеноводородами, образование алкилгалогенидов Спирты легко реагируют с галогеноводородами (HCl, HBr,
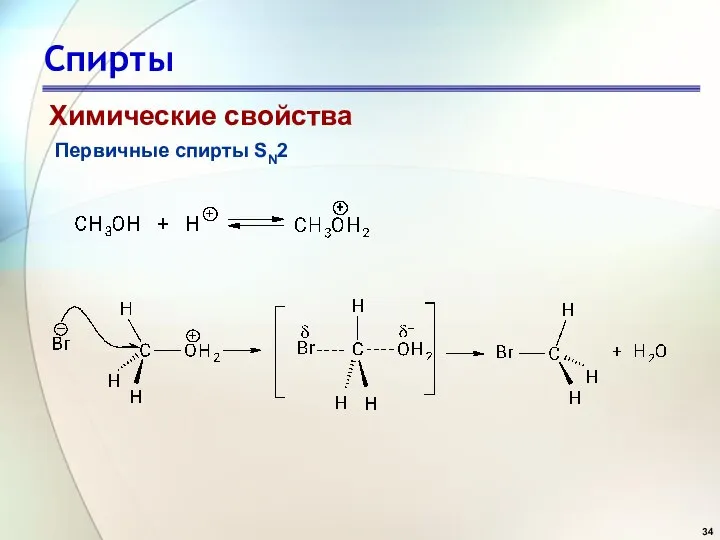
- 34. Спирты Химические свойства Первичные спирты SN2
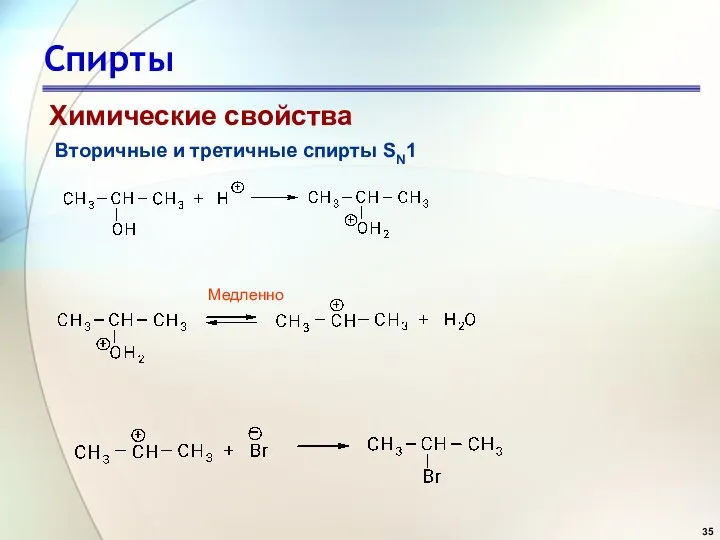
- 35. Спирты Химические свойства Вторичные и третичные спирты SN1 Медленно
- 36. Спирты Химические свойства Вторичные и третичные спирты SN1 Поскольку реакции замещения у вторичных и третичных спиртов
- 37. Спирты Химические свойства Реакционная способность спиртов по отношению к галогенводородам изменяется следующим образом: Бензиловый, аллиловый >
- 38. Спирты Реакции нуклеофильного замещения Реакция с галогенидами фосфора PCl5, PCl3, PBr3, PI3, тионилхлоридом SOCl2. Для получения
- 39. Спирты Реакции нуклеофильного замещения Межмолекулярная дегидратация спиртов. Получение простых эфиров Межмолекулярная дегидратация спиртов в присутствии каталитических
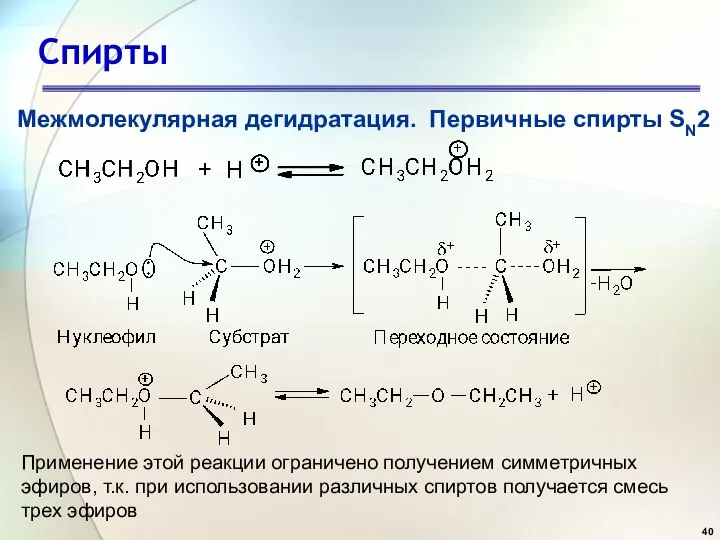
- 40. Спирты Межмолекулярная дегидратация. Первичные спирты SN2 Применение этой реакции ограничено получением симметричных эфиров, т.к. при использовании
- 41. Спирты Получение простых эфиров. Синтез А.Вильямсона. Важным методом получения простых эфиров является реакция алкоголятов с алкилгалогенидами
- 42. Спирты Образование алкенов – внутримолекулярная дегидратация . Спирт превращается в алкен при температуре ~ 200 оС
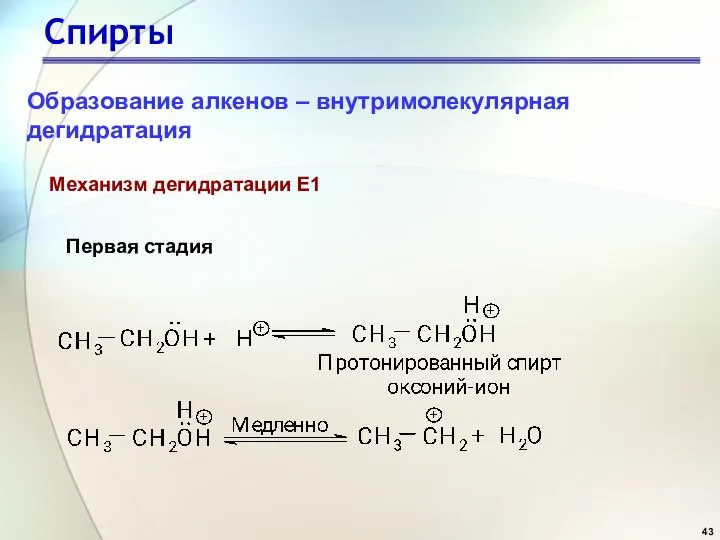
- 43. Спирты Механизм дегидратации Е1 Первая стадия Образование алкенов – внутримолекулярная дегидратация
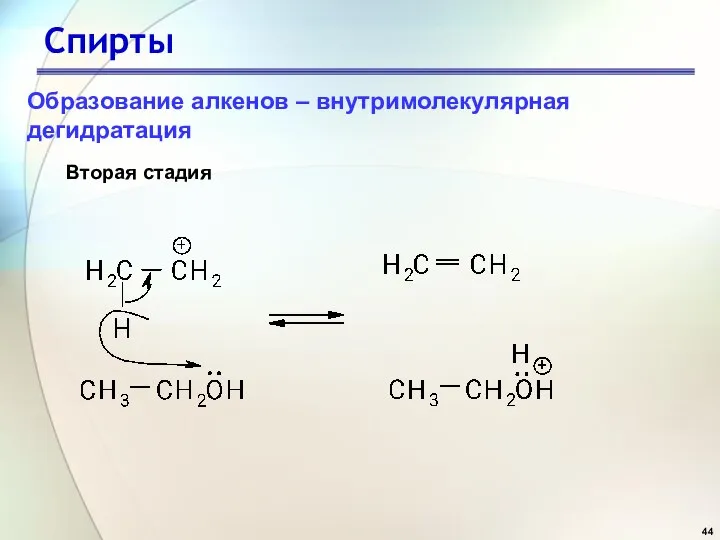
- 44. Спирты Вторая стадия Образование алкенов – внутримолекулярная дегидратация
- 45. Спирты В отличие от галогеналканов, которые подвергаются элиминированию в основном по Е2-механизму, спирты реагируют только по
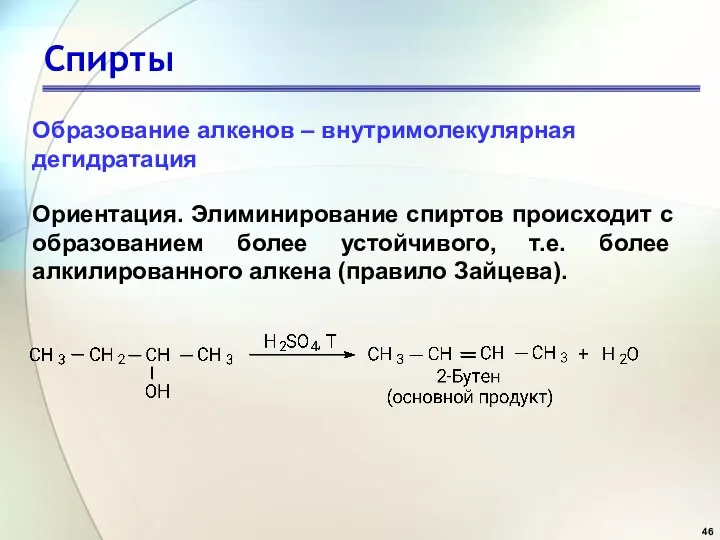
- 46. Спирты Ориентация. Элиминирование спиртов происходит с образованием более устойчивого, т.е. более алкилированного алкена (правило Зайцева). Образование
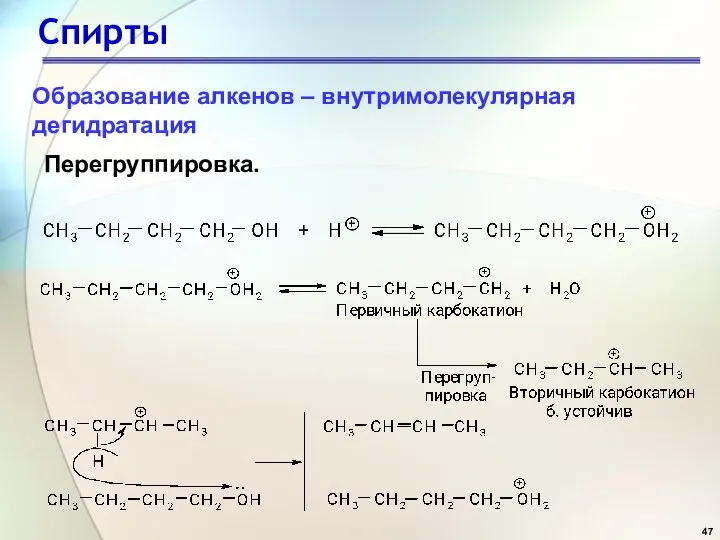
- 47. Спирты Перегруппировка. Образование алкенов – внутримолекулярная дегидратация
- 48. Спирты Реакции окисления Первичные спирты можно окислить до альдегидов действием К2Сr2О7, если одновременно с окислением вести
- 49. Спирты Реакции окисления Вторичные спирты окисляются до кетонов действием перманганата калия или хромовой кислотой. Дальнейшее окисление
- 50. Спирты Реакции окисления Третичные спирты в присутствии кислот превращаются в алкены, которые далее легко окисляются. В
- 51. Спирты Дегидрирование Превращение первичных спиртов в альдегиды, вторичных – в кетоны можно осуществлять, нагревая пары спирта
- 52. Спирты Замещение гидроксигруппы на водород Спирты устойчивы к действию химических восстановителей. Они не восстанавливаются и водородом
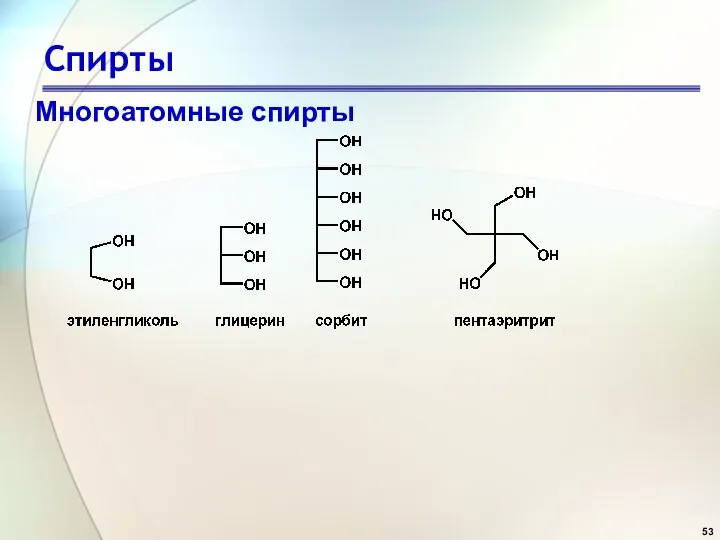
- 53. Спирты Многоатомные спирты
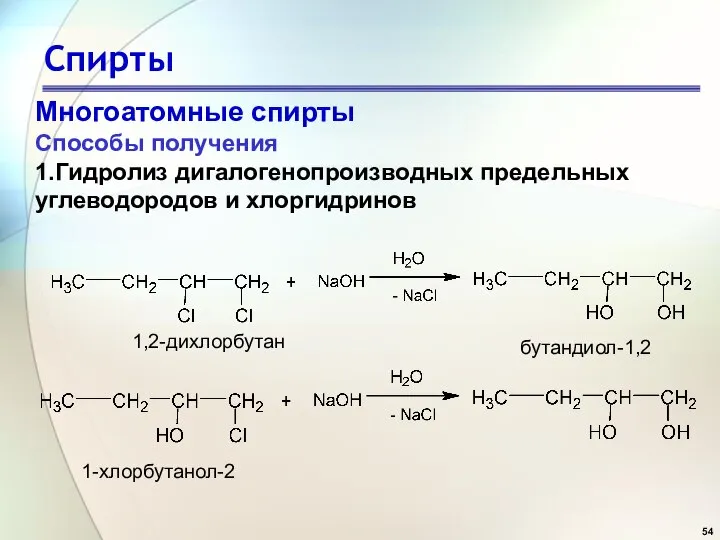
- 54. Спирты Многоатомные спирты Способы получения 1.Гидролиз дигалогенопроизводных предельных углеводородов и хлоргидринов 1,2-дихлорбутан бутандиол-1,2 1-хлорбутанол-2
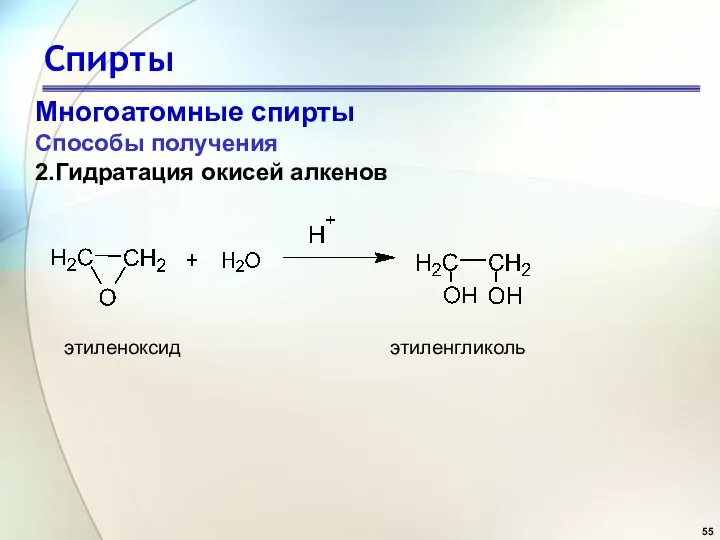
- 55. Спирты Многоатомные спирты Способы получения 2.Гидратация окисей алкенов этиленоксид этиленгликоль
- 56. Спирты Многоатомные спирты Способы получения 3.Окисление алкенов по Вагнеру Под действием холодного разбавленного раствора (5-10%) перманганата
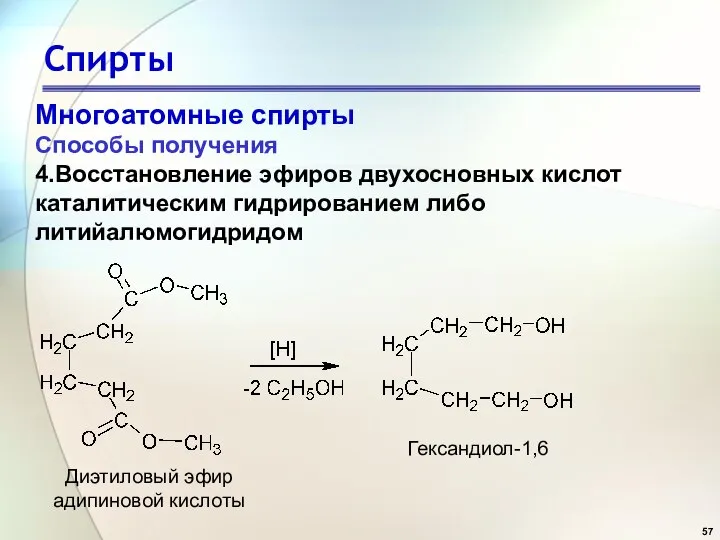
- 57. Спирты Многоатомные спирты Способы получения 4.Восстановление эфиров двухосновных кислот каталитическим гидрированием либо литийалюмогидридом Гександиол-1,6 Диэтиловый эфир
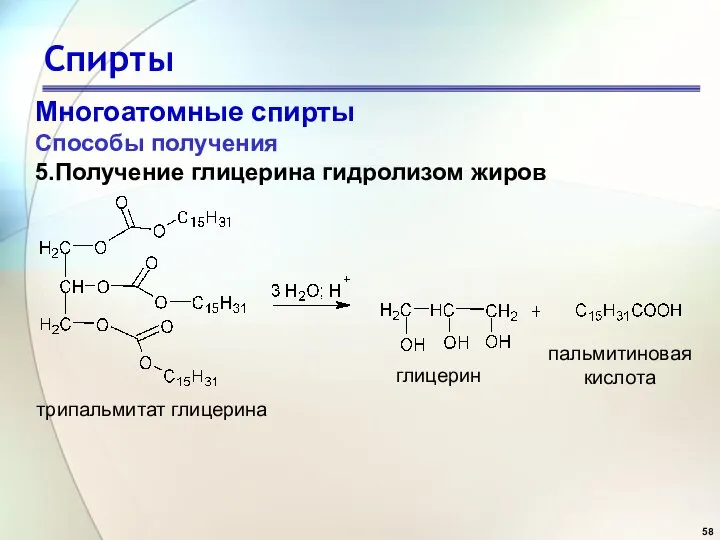
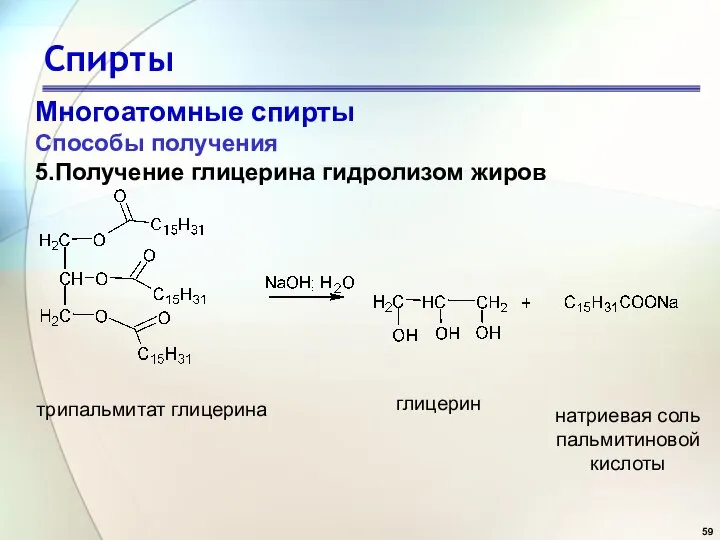
- 58. Спирты Многоатомные спирты Способы получения 5.Получение глицерина гидролизом жиров глицерин пальмитиновая кислота трипальмитат глицерина
- 59. Спирты Многоатомные спирты Способы получения 5.Получение глицерина гидролизом жиров глицерин натриевая соль пальмитиновой кислоты трипальмитат глицерина
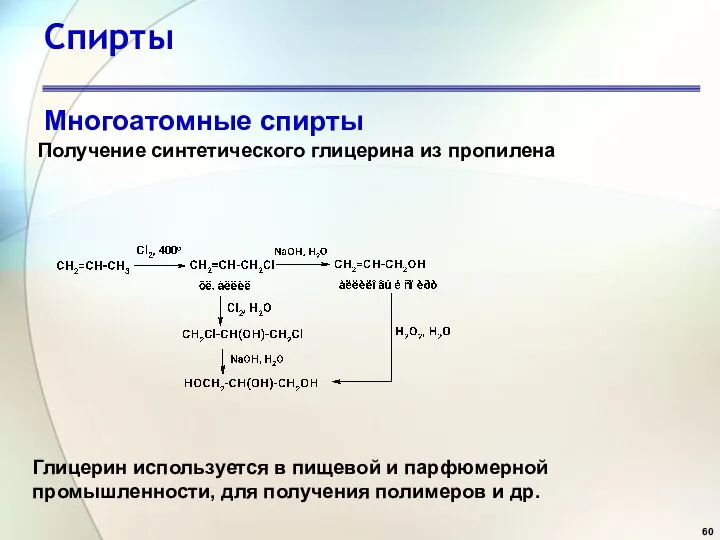
- 60. Спирты Многоатомные спирты Получение синтетического глицерина из пропилена Глицерин используется в пищевой и парфюмерной промышленности, для
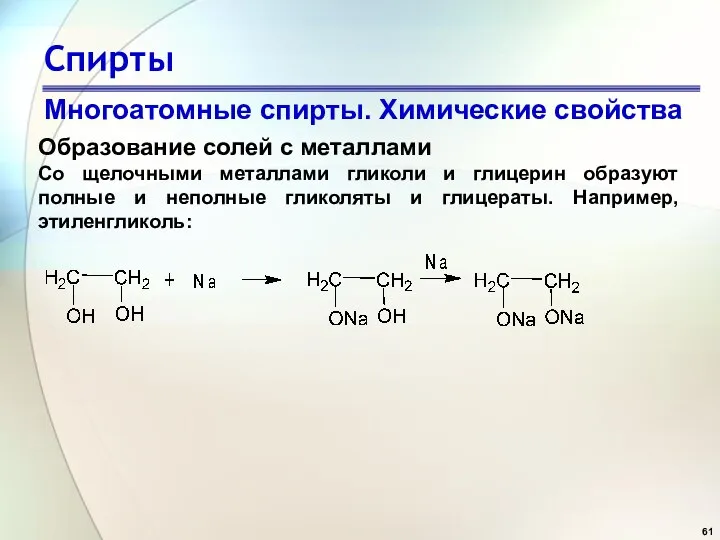
- 61. Спирты Многоатомные спирты. Химические свойства Образование солей с металлами Со щелочными металлами гликоли и глицерин образуют
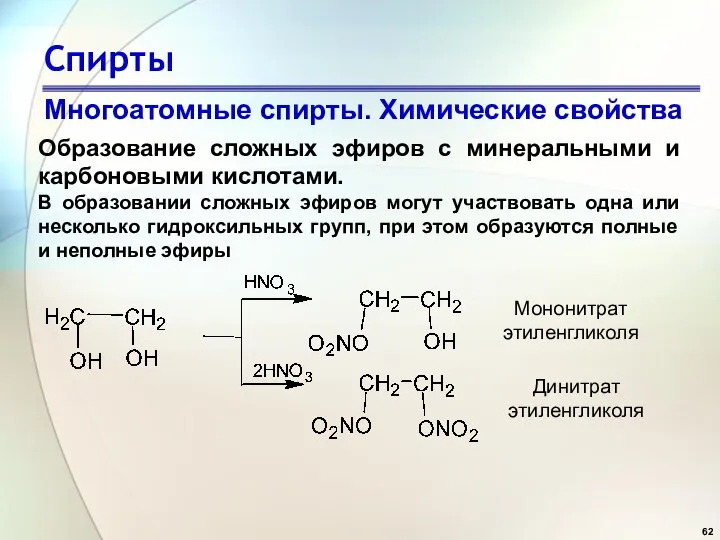
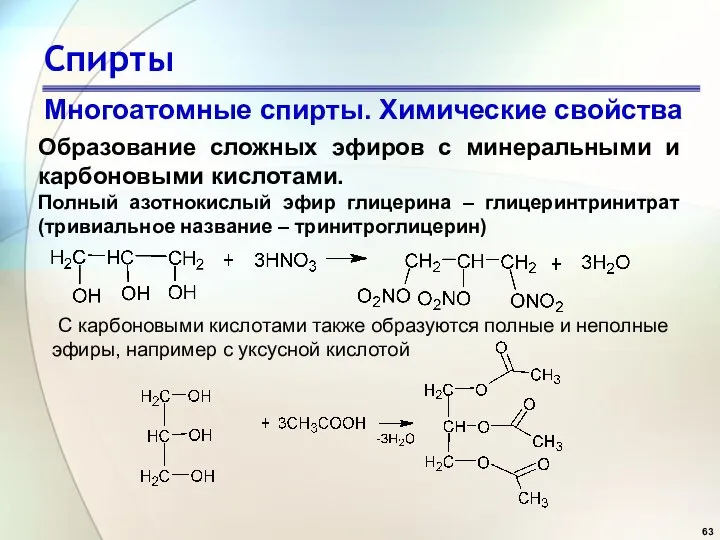
- 62. Спирты Многоатомные спирты. Химические свойства Образование сложных эфиров с минеральными и карбоновыми кислотами. В образовании сложных
- 63. Спирты Многоатомные спирты. Химические свойства Образование сложных эфиров с минеральными и карбоновыми кислотами. Полный азотнокислый эфир
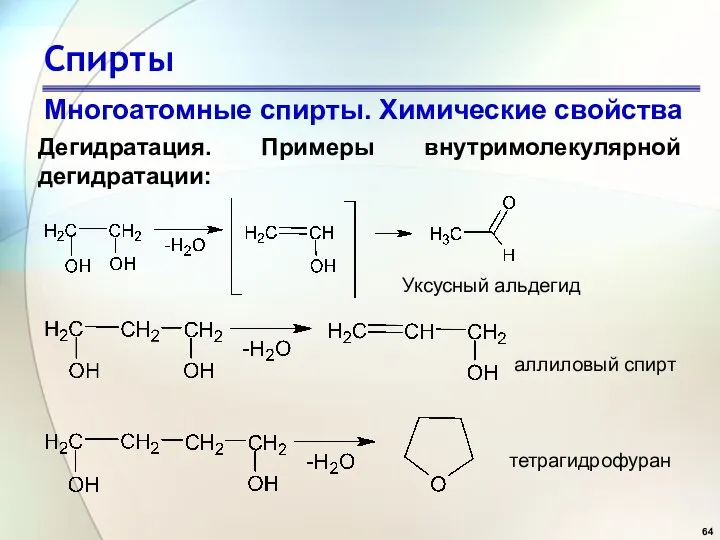
- 64. Спирты Многоатомные спирты. Химические свойства Дегидратация. Примеры внутримолекулярной дегидратации: Уксусный альдегид аллиловый спирт тетрагидрофуран
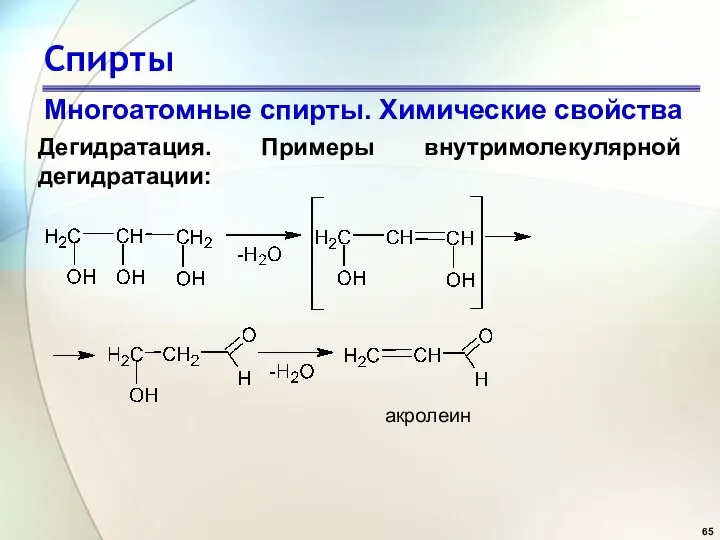
- 65. Спирты Многоатомные спирты. Химические свойства Дегидратация. Примеры внутримолекулярной дегидратации: акролеин
- 67. Скачать презентацию





























 Алканы. Строение и изомерия
Алканы. Строение и изомерия углеводы (1)
углеводы (1) Periodická soustava prvků
Periodická soustava prvků Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Nazwa peptydu. Sekwencja
Nazwa peptydu. Sekwencja Использование ИКТ в преподавании химии. Современный урок
Использование ИКТ в преподавании химии. Современный урок Ионо-дисперсное состояние микрокомпонентов в растворах
Ионо-дисперсное состояние микрокомпонентов в растворах Вещества простые и сложные
Вещества простые и сложные Химические свойства
Химические свойства Спирты
Спирты Физическая химия поверхностных явлений
Физическая химия поверхностных явлений Первый закон термодинамики. Термохимия
Первый закон термодинамики. Термохимия Викторина. Химический элементарий. Д.И. Менделеев – гордость русской науки
Викторина. Химический элементарий. Д.И. Менделеев – гордость русской науки Презентация на тему Изомерия. Изомеры
Презентация на тему Изомерия. Изомеры  Исследование физико-химических свойств растворов сахарозы
Исследование физико-химических свойств растворов сахарозы Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Типы химической связи
Типы химической связи Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Тепловые, массобменные и химические процессы
Тепловые, массобменные и химические процессы Степени окисления химических элементов
Степени окисления химических элементов Водород: знакомый и незнакомый. 9 класс
Водород: знакомый и незнакомый. 9 класс Единый государственный экзамен по ХИМИИ (консультация 3) О.П. Костенко, проректор ГОУ РК «ИПК РО» по НМР
Единый государственный экзамен по ХИМИИ (консультация 3) О.П. Костенко, проректор ГОУ РК «ИПК РО» по НМР Показники нешкідливості води за хімічним складом
Показники нешкідливості води за хімічним складом Презентация на тему Химия и пища
Презентация на тему Химия и пища  Коррозия. способы защиты от коррозии
Коррозия. способы защиты от коррозии Презентация на тему Кислород
Презентация на тему Кислород  Предельные одноосновные карбоновые кислоты
Предельные одноосновные карбоновые кислоты Циклоалканы. Строение молекул
Циклоалканы. Строение молекул