Содержание
- 2. Гипотеза Молекулы простых веществ, образуемых атомами галогенов двухатомны. С увеличением радиуса атомов в ряду F, Cl,
- 3. Цель: -выяснить химические свойства галогенов. Задачи: - провести исследование химических свойств галогенов; - указать условия химических
- 4. Ход исследования Химическая активность фтора исключительна высока. Щелочные металлы, свинец, железо сгорают в атмосфере фтора при
- 5. Свободный хлор проявляет высокую химическую активность, хотя и меньшую чем фтор. Он непосредственно взаимодействует со всеми
- 6. Химическая активность брома меньше, чем у хлора, но все же велика. Со многими металлами и неметаллами(например
- 7. Галогены, стоящие в подгруппе выше, вытесняют нижестоящие из галогенопроизводных кислот и их солей ! Из солей:
- 8. Результаты исследования Таким образом, химическая активность галогенов последовательно уменьшается от фтора к йоду. Каждый галоген в
- 10. Скачать презентацию







 Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Сравнение свойств неорганических и органических веществ
Сравнение свойств неорганических и органических веществ Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів
Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6
Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6 Эмпирические правила
Эмпирические правила Получение галогеноалканов
Получение галогеноалканов Алканы 10-класс
Алканы 10-класс Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Понятие о спиртах
Понятие о спиртах Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1
Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1 Классификация неорганических соединений
Классификация неорганических соединений Химические уравнения
Химические уравнения Водород. Вода
Водород. Вода Атомы химических элементов
Атомы химических элементов Серная кислота. Свойства серной кислоты
Серная кислота. Свойства серной кислоты Приложения для отслеживания проб ALS Geochemistry
Приложения для отслеживания проб ALS Geochemistry Предмет органической химии
Предмет органической химии Презентация по Химии "Sulfur"
Презентация по Химии "Sulfur"  Классификация методов аналитической химии
Классификация методов аналитической химии Химическая связь
Химическая связь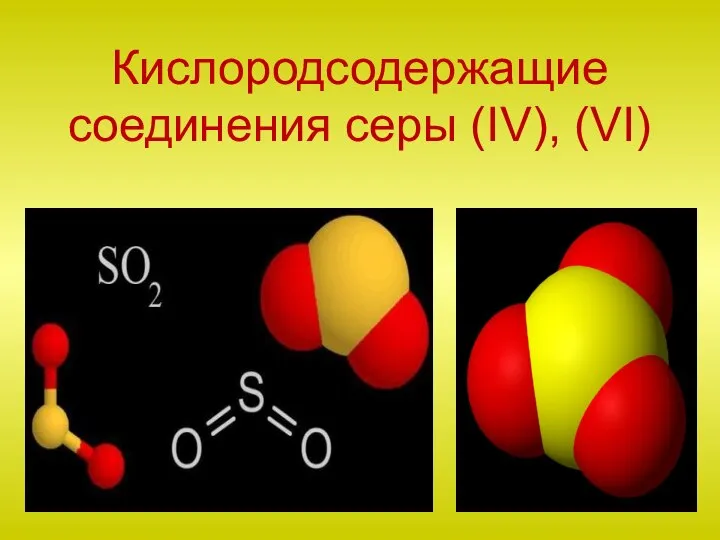 Кислородсодержащие соединения серы (IV), (VI)
Кислородсодержащие соединения серы (IV), (VI) Алкены
Алкены Поликарбонат мономерлері
Поликарбонат мономерлері Презентация на тему Химия в криминалистике
Презентация на тему Химия в криминалистике  Железо и его соединения
Железо и его соединения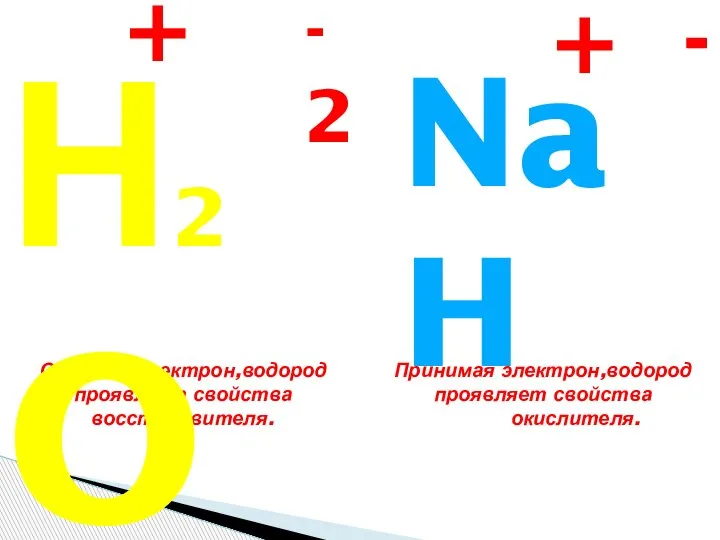 Кислород и водород
Кислород и водород Электролитическая диссоциация
Электролитическая диссоциация Метод валентных связей
Метод валентных связей