Содержание
- 2. Цель лекции
- 3. ПРОВЕРКА ДОМАШНЕГО ЗАДАНИЯ С МЕТОДОМ «МОЗГОВОГО ШТУРМА» Указать тип химических реакций, расставить коэффициенты. P+O2=P2O5 H2O2= H2O
- 4. Необратимые и обратимые реакции Необратимые реакции – реакции, проходящие только в одном направлении − до конца,
- 5. Химическое равновесие - состояние системы, характеризующееся равными скоростями прямой и обратной реакций Система H2 + I2
- 6. Закон действующих масс В закрытой системе в состоянии равновесия при постоянных температуре и давлении отношение произведений
- 7. Константы равновесий в гомогенных и гетерогенных системах Гомогенная система N2(г) + 3H2(г) 2NH3(г) Гетерогенная система MgCO3(к)
- 8. Константа равновесия - мера глубины прохождения реакции Отсутствие взаимодействия Равновесие смещено в сторону прямой реакции Равновесие
- 9. Расчет равновесных концентраций реагентов по известным исходным концентрациям CO(г) + H2O(г) CO2(г) + H2(г) КС =
- 10. Определение возможного направления реакции при известном значении константы равновесия 2SO2(г) + O2(г) 2SO3(г) При Т =
- 11. Влияние температуры на константу химического равновесия зависимость lnK = f(T) близка к линейной При увеличении температуры
- 12. Модуль I. Лекция 4. Химическое равновесие Расчет ΔН0 и ∆S0 реакции 4NO(г) 2N2O(г) + O2(г) ΔН0
- 13. Модуль I. Лекция 4. Химическое равновесие Расчет и K298 реакции 4NO(г) 2N2O(г) + O2(г) Стандартная энергия
- 14. Модуль I. Лекция 4. Химическое равновесие Расчет и K1500 реакции 4NO(г) 2N2O(г) + O2(г) Энергия Гиббса
- 15. Модуль I. Лекция 4. Химическое равновесие График зависимости для реакции 4NO(г) 2N2O(г) + O2(г) Температура, при
- 16. Модуль I. Лекция 4. Химическое равновесие Температурная зависимость константы равновесия реакции 4NO(г) 2N2O(г) + O2(г) 298
- 17. Влияние различных факторов на состояние химического равновесия. Принцип Ле Шателье Если на систему, находящуюся в равновесии,
- 18. Изменение концентраций (парциальных давлений) веществ Влияние концентраций (парциальных давлений) компонентов системы увеличение концентрации продуктов реакции или
- 19. Влияние концентраций веществ на состояние равновесия системы CH4(г) + 2H2O(г) CO2(г) + 4H2(г) Увеличение концентрации CH4
- 20. Влияние общего давления в системе Давление оказывает влияние на равновесие реакций, сопровождающихся изменением количеств газообразных веществ
- 21. Влияние температуры на состояние равновесия Нагревание смещение равновесия в сторону эндотермических реакций Охлаждение смещение равновесия в
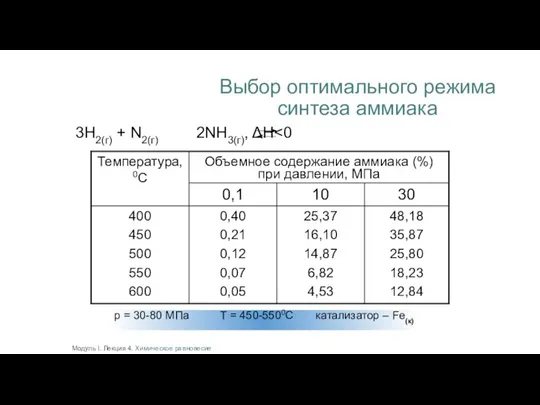
- 22. Выбор оптимального режима синтеза аммиака 3Н2(г) + N2(г) 2NH3(г), ΔH Модуль I. Лекция 4. Химическое равновесие
- 23. Заключение Все самопроизвольные реакции можно разделить на необратимые (идущие в одном направлении) и обратимые (идущие в
- 24. Решение задач методом «Вычислений» Задача-1. Запишите выражения для констант равновесия следующих реакций: а) 2NO(г.) + O2(г.)
- 25. Подведение итогов урока методом «INSERT» 1. Химическое равновесие в системе 2NO(г) + O2 (г) = 2NO2
- 26. Домашняя работа Метод «LEVEL TASKS» Отвечайте на вопросы: Вопрос 1. Что такое гетерогенное реакция? Вопрос 2.
- 27. Рефлексия Если считать, что весь отрезок это 100 %, то покажите точкой ваше местонахождение 1.Усвоение учебного
- 28. Подведение итогов урока : ___ оценка знаний Критерии оценки: Всего 100 баллов
- 30. Скачать презентацию


























 Урок №10 12 класс
Урок №10 12 класс Характеристика элемента по Периодической системе Д.И. Менделеева
Характеристика элемента по Периодической системе Д.И. Менделеева Непредельные углеводороды
Непредельные углеводороды Молибден. Получение молибдена
Молибден. Получение молибдена Алюминий. 9 класс
Алюминий. 9 класс Сульфиды
Сульфиды Презентация на тему Электронное и пространственное строение молекулы метана
Презентация на тему Электронное и пространственное строение молекулы метана 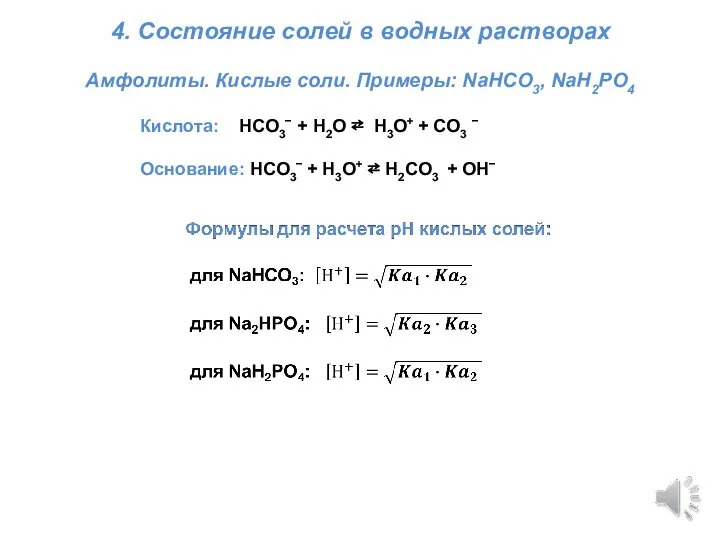 Титриметрия. Состояние солей в водных растворах
Титриметрия. Состояние солей в водных растворах Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры)
Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры) Техника безопасности при работе в химическом кабинете
Техника безопасности при работе в химическом кабинете Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома
Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома Введение в практическую деятельность
Введение в практическую деятельность Диаграмма состояния BaO-Al2O3-SiO2
Диаграмма состояния BaO-Al2O3-SiO2 Ferrum железо
Ferrum железо Обобщение металлов
Обобщение металлов Презентация на тему В мире индикаторов - исследовательская работа
Презентация на тему В мире индикаторов - исследовательская работа  Основные полимеры, используемые для производства электроизоляционных материалов и пропиточных составов
Основные полимеры, используемые для производства электроизоляционных материалов и пропиточных составов Металлическая химическая связь
Металлическая химическая связь Сложные эфиры. Жиры
Сложные эфиры. Жиры Реакции поликонденсации
Реакции поликонденсации Алкены
Алкены Коррозия металлов и сплавов
Коррозия металлов и сплавов Toshkent davlat texnika instituti
Toshkent davlat texnika instituti Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс Синтетические моющие средства
Синтетические моющие средства Инновационное производство синтетических мелкокодисперсных оксидов и оборудования для их изготовления
Инновационное производство синтетических мелкокодисперсных оксидов и оборудования для их изготовления Теория электролитической диссоциации. Контрольный тест
Теория электролитической диссоциации. Контрольный тест Електролітична дисоціація
Електролітична дисоціація