Содержание
- 2. Сегодня на уроке вы узнаете: Понятие о непредельных углеводородах. Характеристика тройной связи. Изомерия и номенклатура алкинов.
- 3. Понятие об алкинах Алкины – углеводороды, содержащие в молекуле одну тройную связь между атомами углерода, а
- 4. Характеристика тройной связи Вид гибридизации – sp Валентный угол – 180 Длина связи С = С
- 5. Схема образования sp -гибридных орбиталей
- 6. Номенклатура алкинов. (Согласно международной номенклатуре названия ацетиленовых углеводородов производят от соответствующего алкана с заменой суффикса –ан
- 7. Гомологический ряд алкинов C2H2 C3H4 C4H6 C5H8 C6H10 C7H12 Этин Пропин Бутин Пентин Гексин Гептин
- 8. Изомерия алкинов Структурная изомерия 1. Изомерия положения тройной связи (начиная с С4Н6): СН ≡С−СН2−СН3 СН3−С≡С−СН3 бутин-1
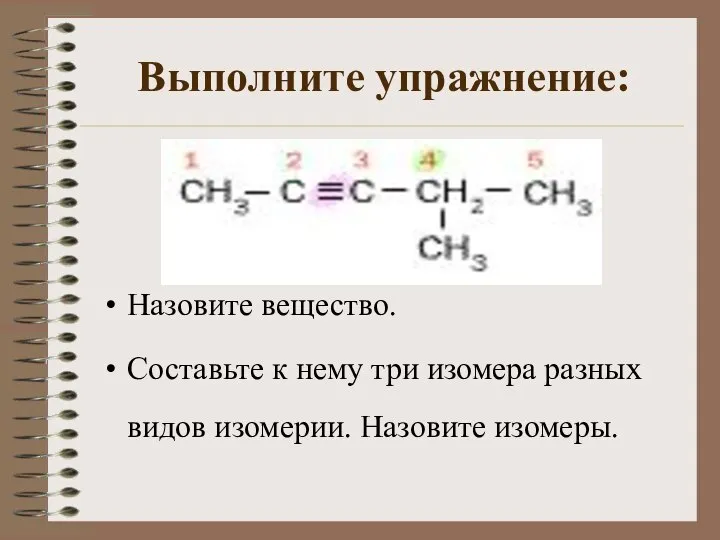
- 9. Выполните упражнение: Назовите вещество. Составьте к нему три изомера разных видов изомерии. Назовите изомеры.
- 10. Физические свойства Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении
- 11. Ацетилен получают в промышленности двумя способами: 1. Термический крекинг метана: 1500°С 2СН4 ⎯⎯→ С2Н2 + 3Н2
- 12. Химические свойства алкинов Химические свойства ацетилена и его гомологов в основном определяются наличием в их молекулах
- 13. Реакции присоединения 1. Галогенирование Обесцвечивание бромной воды является качественной реакцией на все непредельные углеводороды
- 14. 2. Гидрогалогенирование. 3. Гидрирование. 4. Гидратация. HgSO4 Н−C≡C−H + H2O ⎯→ [H−C=C−H] ⎯→ CH3−C−H ⏐ ⏐
- 15. Окисление Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:
- 16. Горение ацетилена При сгорании (полном окислении) ацетилена выделяется большое количества тепла: HC≡CH + 2О2 ⎯→ 2СО2
- 17. Реакции замещения При взаимодействии ацетилена (или R−C≡C−H) с аммиачными растворами оксида серебра выпадают осадки нерастворимых ацетиленидов:
- 18. Реакция полимеризации 1. Димеризация под действием водного раствора CuCl и NH4Cl: НC≡CH + НC≡CH ⎯→ Н2C=CH−C≡CH
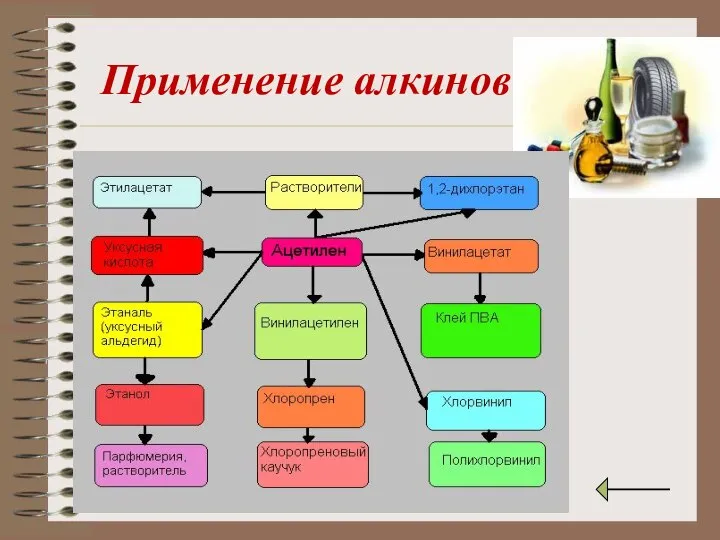
- 19. Применение алкинов
- 21. Скачать презентацию











![2. Гидрогалогенирование. 3. Гидрирование. 4. Гидратация. HgSO4 Н−C≡C−H + H2O ⎯→ [H−C=C−H]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/930980/slide-13.jpg)




 Предпосылки открытия Периодического закона Д. И. Менделеевым
Предпосылки открытия Периодического закона Д. И. Менделеевым SHOT.шампуни. Состав. Компоненты
SHOT.шампуни. Состав. Компоненты Ķīmiskais līdzsvars un faktori, kas to ietekmē
Ķīmiskais līdzsvars un faktori, kas to ietekmē Физико-химические свойства растворов ВМС
Физико-химические свойства растворов ВМС Презентация на тему Озоновая дыра
Презентация на тему Озоновая дыра  Алюминий. Положение алюминия в периодической системе и строение его атома
Алюминий. Положение алюминия в периодической системе и строение его атома Анализ образца доломита методами аналитической химии
Анализ образца доломита методами аналитической химии Типы химической связи
Типы химической связи Расшифровка структуры гликозидов
Расшифровка структуры гликозидов Композитные материалы
Композитные материалы Производные углеводородов
Производные углеводородов Основи прийняття рішень, щодо захисту населення під час різних фаз радіаційної аварії. Критерії для прийняття рішень
Основи прийняття рішень, щодо захисту населення під час різних фаз радіаційної аварії. Критерії для прийняття рішень Основания
Основания Электроотрицательность
Электроотрицательность Диены. Понятие о диенах
Диены. Понятие о диенах Заманауи косметика биотехнологиясы
Заманауи косметика биотехнологиясы Презентация Продукции Opet (3)
Презентация Продукции Opet (3) Закон Авогадро
Закон Авогадро Решение задач на основные законы и понятия химии
Решение задач на основные законы и понятия химии Биогаз. Технология производства
Биогаз. Технология производства Презентация на тему Изомерия
Презентация на тему Изомерия  Алкины
Алкины Тела и вещества. Химический диктант
Тела и вещества. Химический диктант Вермикулит. Технические характеристики
Вермикулит. Технические характеристики Основания. Щелочи – растворимые основания
Основания. Щелочи – растворимые основания Реакции ионного обмена
Реакции ионного обмена Особенности строения электронных оболочек атомов элементов больших периодов
Особенности строения электронных оболочек атомов элементов больших периодов Последовательные реакции
Последовательные реакции