Содержание
- 2. Одинокий жил металл, Гидроксогруппе дружбу предлагал И в любви признание, Это – основание !
- 3. А если серьезно ?
- 4. ОСНОВАНИЯ- это сложные вещества, состоящие из атомов металлов и гидроксогрупп.
- 5. ГИДРОКСОГРУППА - это группа ОН , ее валентность I
- 6. В гидроксиде натрия атом натрия соединен с одной гидроксогруппой
- 7. ОСНОВАНИЯ– это ГИДРОКСИДЫ МЕТАЛЛОВ П р и м е р ы Гидроксид натрия – NaOH Гидроксид
- 8. Каковы формулы гидроксидов калия, бария и меди (II) ?
- 9. ОТВЕТЫ: Гидроксид калия – КОН Гидроксид бария - Ва (ОН)2 Гидроксид меди (II) – Cu (ОН)2
- 10. ЕСЛИ ТЫ ВЕРНО СОСТАВИЛ ФОРМУЛЫ, МО - ЛО - ДЕЦ ! А ЕСЛИ ТЫ ОШИБСЯ….
- 11. А если ты ошибся тут, Начинай сначала! Знай: число гидроксогрупп Равно валентности металла .
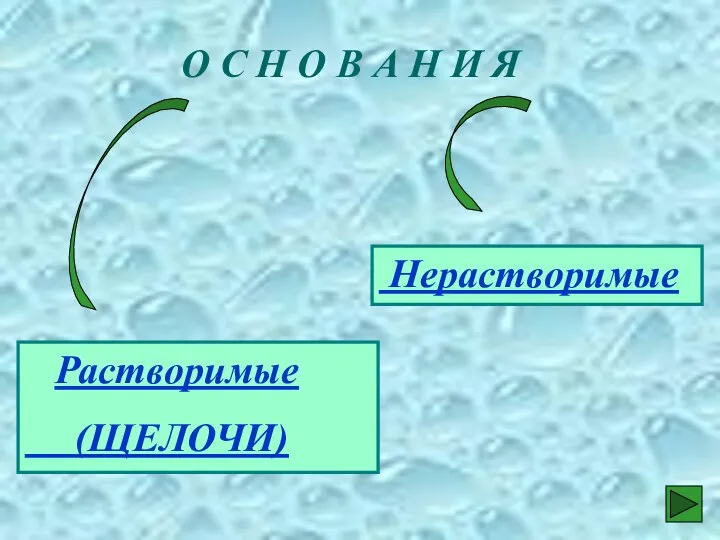
- 12. О С Н О В А Н И Я Растворимые (ЩЕЛОЧИ) Нерастворимые
- 13. СВОЙСТВА ЩЕЛОЧЕЙ
- 14. При растворении щелочей в воде выделяется тепло.Растворы щелочей «мылкие» на ощупь. Концентрированные растворы щелочей разрушают ткани
- 16. А теперь о химических свойствах ЩЕЛОЧЕЙ
- 17. В щелочах фиолетовый лакмус становится синим
- 18. В щелочах оранжевый метилоранж становится желтым
- 19. Но лучший индикатор для щелочей – это ФЕНОЛФТАЛЕИН, потому что он бесцветный в кислой и нейтральной
- 20. Попасть в кислоту Нету горше удачи… Но он перетерпит Без вздоха, без плача. Зато в щелочах
- 21. Основное взаимодействует с кислотным, П О Э Т О М У…….
- 22. Щелочи (основания) взаимодействуют с кислотами и кислотными оксидами. NaOH +HCl = Ba(OH)2 + CO2 = При
- 23. СВОЙСТВА нерастворимых оснований
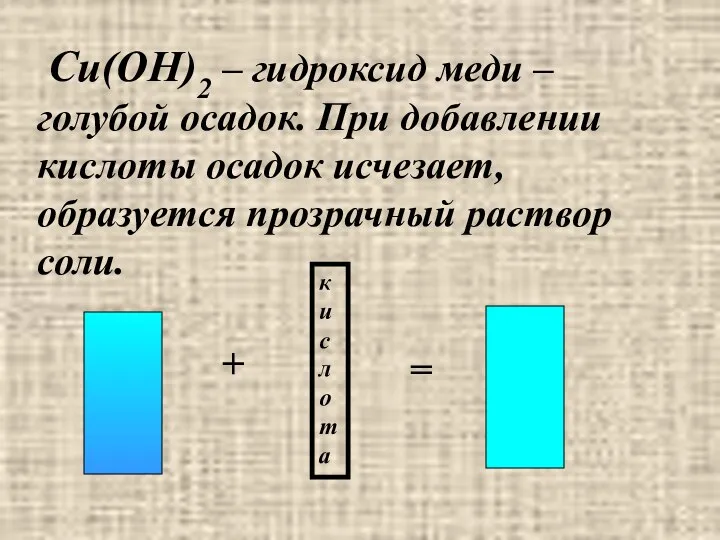
- 24. Cu(OH)2 – гидроксид меди – голубой осадок. При добавлении кислоты осадок исчезает, образуется прозрачный раствор соли.
- 25. Следовательно, нерастворимые основания взаимодействуют с кислотами с образованием соли и воды. Cu(OH)2 + H2SO4 = CuSO4
- 27. Скачать презентацию






















 Презентация на тему Изучение реакции среды в зависимости от типа гидролиза соли
Презентация на тему Изучение реакции среды в зависимости от типа гидролиза соли  Общие свойства металлов
Общие свойства металлов Новые грани парфюмерии. Задача 5
Новые грани парфюмерии. Задача 5 Презентация на тему Природные источники углеводородов (9 класс)
Презентация на тему Природные источники углеводородов (9 класс)  Химия. Ребусы
Химия. Ребусы Понятие о химической реакции. Реакции, идущие без изменения состава веществ
Понятие о химической реакции. Реакции, идущие без изменения состава веществ Влияние метилового спирта на организм человека
Влияние метилового спирта на организм человека Коррозия металлов и сплавов
Коррозия металлов и сплавов Материаловедение. Строение металлических материалов. Металлические сплавы
Материаловедение. Строение металлических материалов. Металлические сплавы Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена
Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена Презентация на тему Бинарные соединения
Презентация на тему Бинарные соединения  Презентация на тему Производство аммиака
Презентация на тему Производство аммиака  Подготовка к контрольной работе. 8 класс
Подготовка к контрольной работе. 8 класс Тренинг по решению задач разной степени сложности по теме Углеводороды
Тренинг по решению задач разной степени сложности по теме Углеводороды Лабораторное оборудование, посуда и средства защиты
Лабораторное оборудование, посуда и средства защиты Металлы. Тестирование
Металлы. Тестирование Эвапориты. Химические осадки из ионных растворов
Эвапориты. Химические осадки из ионных растворов Химические свойства алканов. Алканы
Химические свойства алканов. Алканы Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry
Development of the system of concepts on the topic redox reactions in the school course of inorganic chemistry Полезные кирпичи окружающего мира
Полезные кирпичи окружающего мира Цитология
Цитология Техносферная безопасность. Химия как наука
Техносферная безопасность. Химия как наука Презентация на тему Биотехнологии. Генная инженерия
Презентация на тему Биотехнологии. Генная инженерия  Химическое равновесие
Химическое равновесие Substanță chimică
Substanță chimică Карбоновые кислоты
Карбоновые кислоты Презентация на тему Химия наука о веществах
Презентация на тему Химия наука о веществах  Вуглеводи. Групи
Вуглеводи. Групи