Содержание
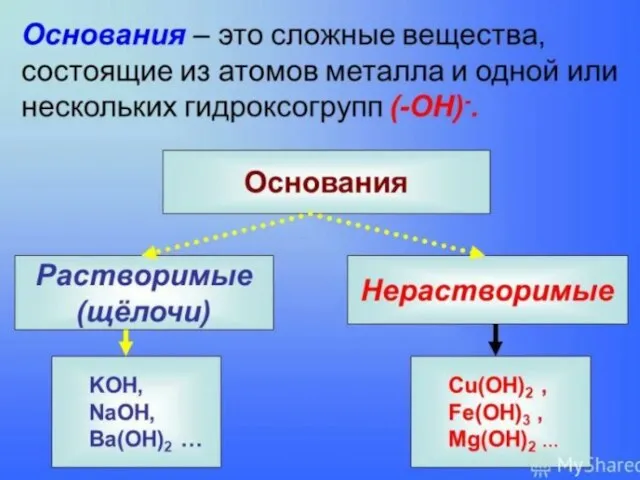
- 5. Щелочи – растворимые основания (10) NaOH Ba(OH)2
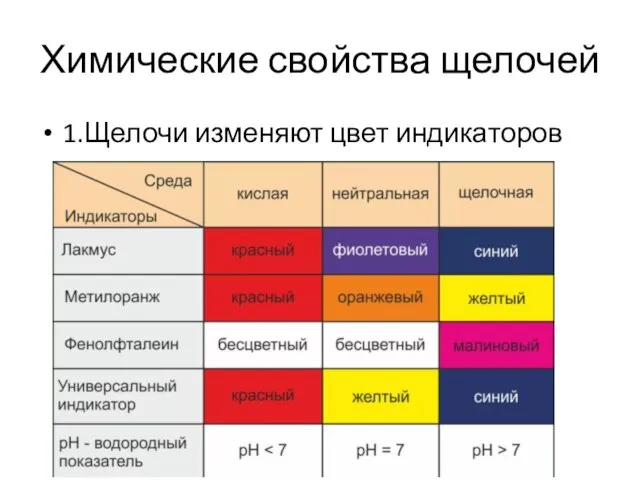
- 6. Химические свойства щелочей 1.Щелочи изменяют цвет индикаторов
- 7. 2.Щелочь + кислота = соль + Н2О Сa(OH)2 + 2 HNO3 = Ca(NO3)2 + 2H2O (ф-ф)
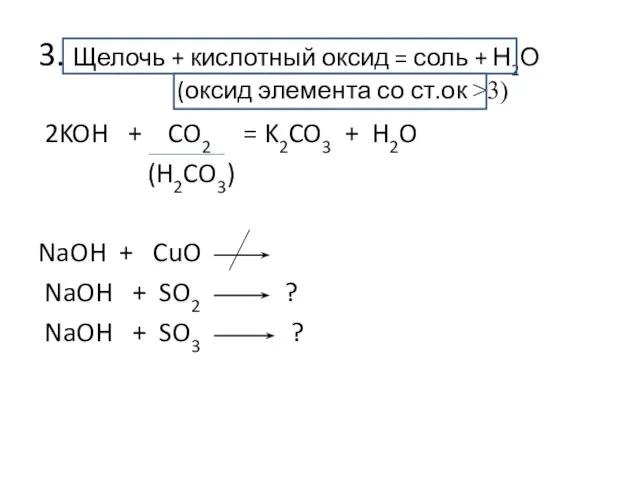
- 8. 3. Щелочь + кислотный оксид = соль + Н2О (оксид элемента со ст.ок >3) 2KOH +
- 9. 4. Щелочь + соль = новая соль + новое основание Реакция происходит, если образуется хотя бы
- 10. FeCl3 + 3 NaOH = Fe(OH)3 + 3 NaCl BaCl2 + KOH Al2(SO4)3 + NaOH
- 11. Нерастворимые основания
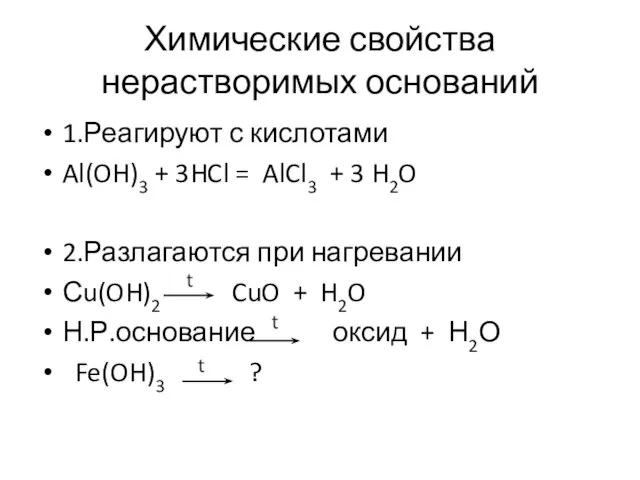
- 12. Химические свойства нерастворимых оснований 1.Реагируют с кислотами Al(OH)3 + 3HCl = AlCl3 + 3 H2O 2.Разлагаются
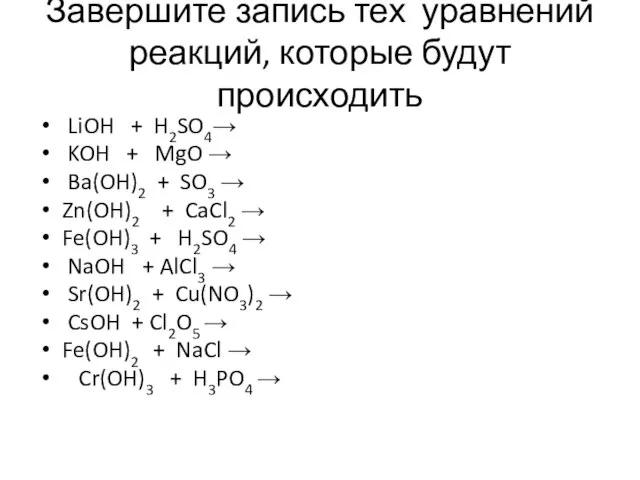
- 13. 1.Завершите запись тех уравнений реакций, которые будут происходить, если реакция не происходит, стрелочку зачеркните и объясните,
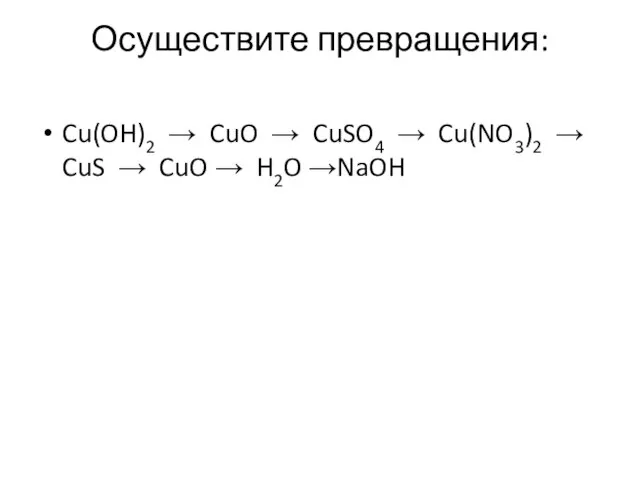
- 14. Осуществите превращения: Cu(OH)2 → CuO → CuSO4 → Cu(NO3)2 → CuS → CuO → H2O →NaOH
- 15. Завершите запись тех уравнений реакций, которые будут происходить LiOH + H2SO4→ KOH + MgO → Ba(OH)2
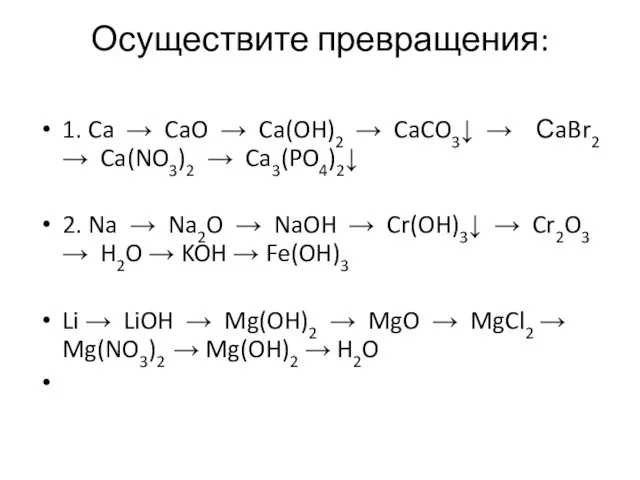
- 16. Осуществите превращения: 1. Ca → CaO → Ca(OH)2 → CaCO3↓ → СaBr2 → Ca(NO3)2 → Ca3(PO4)2↓
- 18. Скачать презентацию





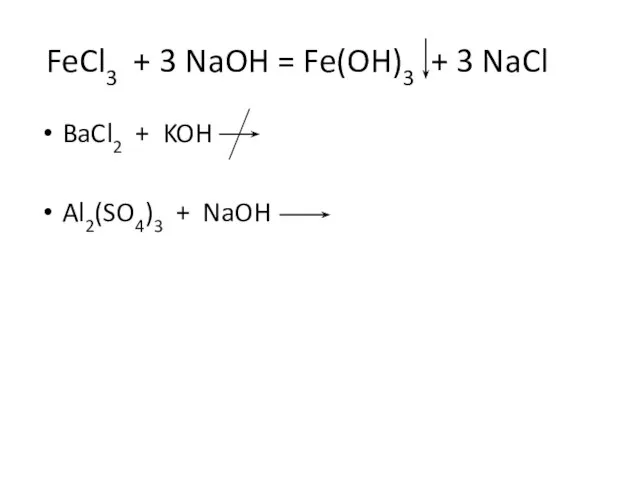


 Изучение свойств анилина. Лабораторная работа №18
Изучение свойств анилина. Лабораторная работа №18 Кислоты в химии
Кислоты в химии Азотная кислота
Азотная кислота Кремний и его соединения
Кремний и его соединения Спирт. Виды спиртов
Спирт. Виды спиртов Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа
Закалка и отпуск стали. Ознакомление со структурами серого и белого чугуна. Распознавание руд железа Фосфор и его соединения. Минеральные удобрения
Фосфор и его соединения. Минеральные удобрения Ароматические углеводороды
Ароматические углеводороды Чемпионат НХЛ (национальной химической лиги)
Чемпионат НХЛ (национальной химической лиги) Буферные системы
Буферные системы Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение
Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение Винная кислота
Винная кислота СПИРТЫ, ФЕНОЛЫ
СПИРТЫ, ФЕНОЛЫ Слюда. История открытия
Слюда. История открытия Понятие о химической реакции. Реакции, идущие без изменения состава веществ
Понятие о химической реакции. Реакции, идущие без изменения состава веществ Диффузия и осмос
Диффузия и осмос Золото
Золото Алюминий
Алюминий Prezentatsia_k_uroku
Prezentatsia_k_uroku Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Оценка пригодности природной воды в качестве питьевой по формуле М.Г. Курлова Классификация реакций
Классификация реакций Материаловедение. Методы исследования в материаловедении (лекция 1)
Материаловедение. Методы исследования в материаловедении (лекция 1) Ароматические углеводороды. Строение молекулы бензола. Физические свойства
Ароматические углеводороды. Строение молекулы бензола. Физические свойства Этапы приготовления и микроскопического исследования нативного препарата осадка мочи
Этапы приготовления и микроскопического исследования нативного препарата осадка мочи Углеводы. Классификация, cтроение
Углеводы. Классификация, cтроение Предельные углеводороды. Лекция 2
Предельные углеводороды. Лекция 2 Химия и жизнь
Химия и жизнь Графический диктант. Азот и Аммиак
Графический диктант. Азот и Аммиак