Слайд 2Цель работы:
Провести количественное определение Fe и Ca,
содержащихся в модельном растворе образца доломита.
Задачи:
Изучить

примерный состав природного доломита
Составить схему качественного анализа на основе изученной литературы
Провести качественный анализ модельного раствора
На основе полученных данных, составить схему количественного анализа раствора
Определить концентрацию Fe и Ca, оценить суммарную погрешность определения
Проверить правильность результата для железа путем сравнения равноточности двух методов
Слайд 3Доломит.
Доломи́т — минерал из класса карбонатов, а также осадочная карбонатная горная порода, состоящая из этого

минерала на 95 % и более. Получил название вчесть французского инженера и геолога Деода де Доломьё (1750—1801), описавшего признакидоломитовых пород.
Используется в стекольной промышленности, в производстве флюсов, огнеупорных материалов, облицовочных материалов, в агропромышленности (для раскисления и удобрения почв)
Слайд 4Состав породы:
CaCO3*MgCO3
CaO – 30.4%
MgO – 21.7%
CO2 – 47.9%
В качестве примесей входит Fe

и Mn,
реже Sr, Zn, Ni
Слайд 5Отбор средней пробы
Отбор проб кускового доломита производят от штабелей до погрузки

или после выгрузки его из транспортных средств не менее чем из 30 равномерно удаленных друг от друга участков штабеля. Точечную пробу массой не менее 0.5 кг на каждом участке отбирают от 10 соприкасающихся друг с другом кусков доломита откалыванием молотком кусочков массой не менее 50 г. Все отобранные точечные пробы соединяют в объединенную пробу, тщательно перемешивают и методом квартования сокращают до массы не менее 4 кг. Полученную пробу измельчают на лабораторных бегунах или валковой дробилке до крупности не более 1 мм, сокращают методом квартования до массы 1 кг и тем же методом делят на две равные части, которые помещают в полиэтиленовые пакеты или стеклянные банки и снабжают этикетками с указанием соответствующих параметров.
Слайд 6Пробоподготовка
Согласно методикам ГОСТ 23673.1-79, навеску молотого доломита предлагается смочить водой, а затем

осторожно прилить некоторое количество кислоты (4 мл.). После частичного растворения добавляют еще 50 мл воды, перемешивают, кипятят, периодически разминая материал стеклянной палочкой. По окончанию выделения пузырьков при наличии нерастворенного остатка его фильтруют, промывают 8-10 раз горячей водой, собирая промывные воды в ту же колбу. Фильтрат охлаждают, доводят до метки и перемешивают.
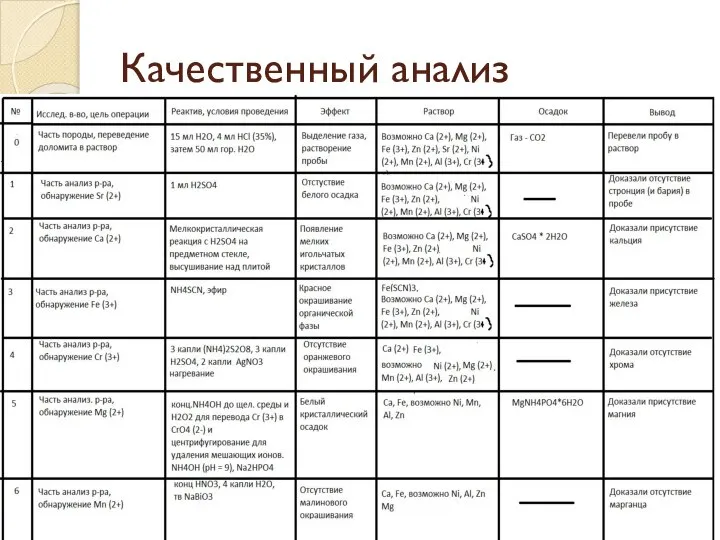
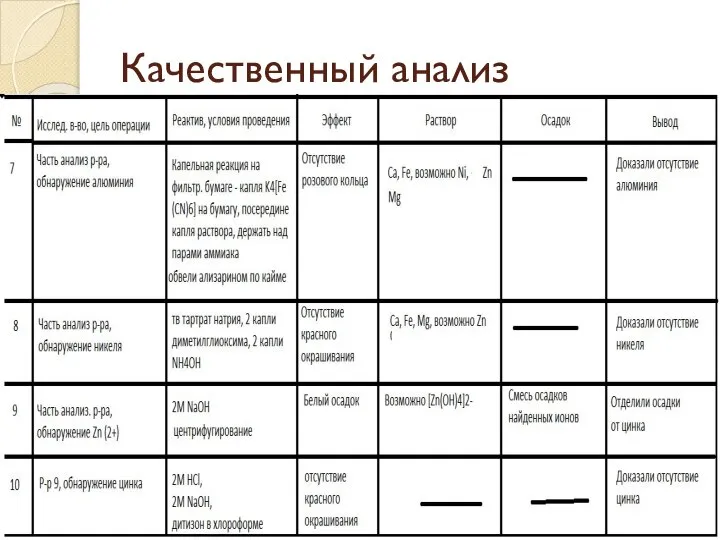
Слайд 9Итог качественного анализа
Было доказано присутствие Fe (3+), Ca, Mg
Было доказано отсутствие Cr

(3+), Sr, Ba, Al, Ni, Mn, Zn
Слайд 10Количественный анализ
Исходя из полученных данных, была предложена следующая схема количественного анализа:
Определение железа
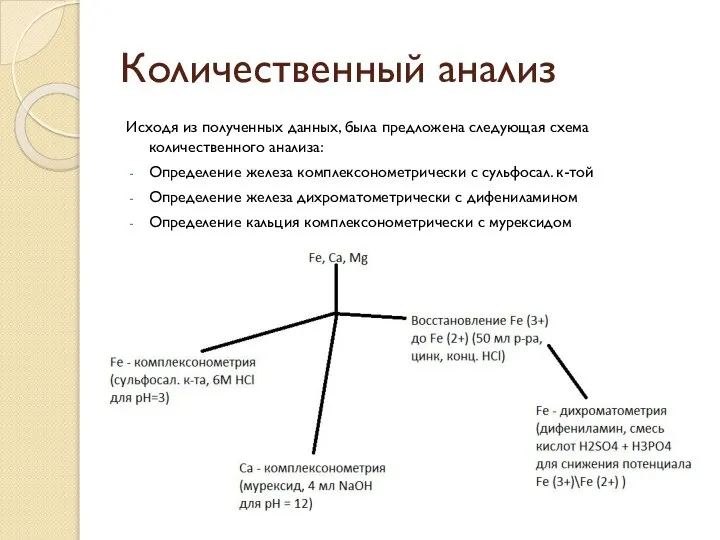
комплексонометрически с сульфосал. к-той
Определение железа дихроматометрически с дифениламином
Определение кальция комплексонометрически с мурексидом
Слайд 11Определение кальция
К 10 мл анализируемого раствора прилили 3 мл триэтаноламина и 4.5

мл NaOH. Затем прибавили пару шпателей мурексида, наблюдали интенсивное фиолетовое окрашивание. Титровали раствором ЭДТА до устойчивого перехода цвета раствора в синий.
Ca (2+) + Y (4-) => CaY (2-)
Слайд 13Определение железа комплексонометрически
К 10 мл аликвоты добавляют NH4OH до появления мути, растворяют

ее несколькими каплями 6М HCl, затем добавляют 4 мл 4М HCl, что сопровождалось изменением цвета на ярко-зеленый (Соли Fe(3+)) добавляют примерно 10-15 мл H2O, несколько капель сульфосалициловой кислоты, перемешивают и доводят до кипения. При этом раствор принял фиолетовую окраску. После этого раствору дали остыть и провели титрование комплексоном III, наблюдали переход окраски из фиолетовой в желтую
Слайд 14Определение железа комплексонометрически

Слайд 15Определение железа дихроматометрически
Для восстановления было отобрано 50 мл анализируемого раствора, к которому

прибавили около 20 гранул цинка и 30 мл конц HCL. Полученный раствор поставили на плиту, колбу накрыли воронкой, наблюдали выделение газа и постепенное обесцвечивание раствора. Проверяли окончание восстановления качественной реакцией с тиоционатом, когда раствор не дал красную окраску, колбу сняли с плиты, остудили. Раствор был профильтрован через вату и количественно перенесен в мерную колбу на 100 мл, доведен до метки водой, перемешан. Затем аликвоты полученного раствора объемом 10 мл были перенесены в колбы для титрования, к ним добавили смесь кислот (H2SO4+H3PO4) и 5 капель дифениламина. При титровании наблюдали переход окраски со светло- до темно-зеленого, а при достижении ктт в фиолетовый.
Fe(3+) + e = Fe(2+), E = 0,771 B
Fe(3+) + 2H2SO4 => Fe(SO4)2 (-), E (Fe(SO4)2 (-)\FeSO4) = 0,68 B
Fe(3+) + H2PO4(-) => FeH2PO4(2+), Eитог (Fe(3+)\Fe(2+)) = 0,60 B
2Fe(3+)+Zn => 2Fe(2+) +Zn(2+)
Fe(3+) +3SCN(-) => Fe(SCN)3
6Fe(2+) +Cr2O7(2-)+14H(+) =>6Fe(3+) + 2Cr(3+) +7H2O
Cr2O7(2-) + 6e +14H(+)=> 2Cr(3+) +7H2O, E = 1,33 B
Слайд 16Определение железа дихроматометрически
Fe(3+) + e = Fe(2+), E = 0,771 B
Fe(3+) +

2H2SO4 =>
Fe(SO4)2 (-), E (Fe(SO4)2 (-)\
\FeSO4) = 0,68 B
Fe(3+) + H2PO4(-) =>
FeH2PO4(2+),
Eитог (Fe(3+)\Fe(2+)) = 0,60 B
2Fe(3+)+Zn => 2Fe(2+) +Zn(2+)
Fe(3+) +3SCN(-) => Fe(SCN)3
6Fe(2+) +Cr2O7(2-)+14H(+) =>
6Fe(3+) + 2Cr(3+) +7H2O
Cr2O7(2-) + 6e +14H(+)=>
=> 2Cr(3+) +7H2O
Слайд 17Проведение проверки правильности

Слайд 18Выводы
Мы изучили состав модельного раствора доломита с использование методик качественного и количественного

анализа. Предложенный раствор содержал Fe, Ca и Mg. Среднее содержание железа можно выразить как (0,337±0,005) грамм в 200 мл раствора (или 1.6234 гр. теор. навески), в то время как содержание оксида кальция можно оценить как (0.4935±0.0039) грамм на 200 мл раствора.
Слайд 19Вывод
Мы изучили методику определения содержания ионов магния комплексонометрическим титрованием.

















 Соли Na2SO4
Соли Na2SO4 Конструкционные и функциональные материалы: конструкционные материалы. Введение
Конструкционные и функциональные материалы: конструкционные материалы. Введение Механизмы и методы формирования кристаллов
Механизмы и методы формирования кристаллов Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас
Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас Сравнительный анализ питьевой бутилированной воды
Сравнительный анализ питьевой бутилированной воды Физические и химические явления 8 класс Учитель химии Кузнецова А.Н.
Физические и химические явления 8 класс Учитель химии Кузнецова А.Н. ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ. Презентация на тему Общая характеристика металлов главных подгрупп I-III
Презентация на тему Общая характеристика металлов главных подгрупп I-III  Липиды
Липиды Презентация на тему Производство чугуна и стали
Презентация на тему Производство чугуна и стали  Термопласты: основные представители, сравнение свойств и область их применения
Термопласты: основные представители, сравнение свойств и область их применения Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем
Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Основные классы неорганических соединений
Основные классы неорганических соединений Три агрегатных состояния веществ
Три агрегатных состояния веществ Gelation in aqueous solution of L-cysteine and silver nitrate
Gelation in aqueous solution of L-cysteine and silver nitrate metally_mikhaylets
metally_mikhaylets Презентация по Химии "Классификация реакций в неорганической химии"
Презентация по Химии "Классификация реакций в неорганической химии"  Презентация на тему Химия и пища
Презентация на тему Химия и пища  Соли
Соли Все свойства минералов
Все свойства минералов Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение
Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение Структура периодической таблицы элементов
Структура периодической таблицы элементов Что такое эксперимент?
Что такое эксперимент? лекция 1-к.н.с.-ИАИТ-2022
лекция 1-к.н.с.-ИАИТ-2022 alkany_stroenie_nomenklatura_izomeriya_10_klass (3)-1
alkany_stroenie_nomenklatura_izomeriya_10_klass (3)-1 Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А.
Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А.