Содержание
- 2. Реакции Фаворского Обычно галогенкетон смешивают с концентрированным раствором основания (напр., в спирте) или с суспензией основания
- 3. Реакции Фаворского α,α-Дигалогенкетоны и α,αʹ-дигалогенкетоны, содержащие α-H-атомы* в условиях Фаворского реакции образуют одну и ту же
- 4. Основные побочные продукты - эпоксиэфиры ф-лы I, образующиеся из них гидроксикетали и α-гидроксикетоны, продукты расщепления связей
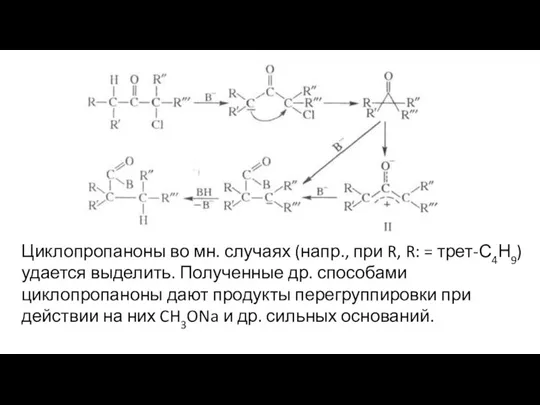
- 5. Циклопропаноны во мн. случаях (напр., при R, R: = трет-С4Н9)удается выделить. Полученные др. способами циклопропаноны дают
- 6. Реакции Фаворского Квазиперегруппировка Фаворского протекает по так называемому Семибензильному механизму:
- 7. Реакции Фаворского Превращения, аналогичные этой перегруппировке, претерпевают под действием оснований амиды α-галогенкарбоновых кислот, α-галогеналкилсульфамиды, α-галогеналкилсульфоны, α-гидроксикетоны
- 8. Реакция Реппе Синтез карбоновых кислот и их производных взаимодействуют СО с различными органическими соединениями (в т.ч.
- 9. Реакция Реппе Реппе реакция относится к реакциямциям карбонилирования. Ее осуществляют в присутствии карбонилов металлов (обычно карбонилы
- 10. Реакция Реппе Карбонилирование ацетилена приводит к акриловой кислоте. Монозамещенные ацетилены обычно образуют один продукт, дизамещенные-два возможных
- 11. Селективность карбонилирования сопряженных диенов значительно зависит от условий реакции. Так, в реакции 1,4-бутадиена в присутсвие пиридина
- 12. Карбонилирование метанола до уксусной кислоты с использованием карбонилов Со или Ni происходит в очень жестких условиях
- 13. Синтез простых и сложных виниловых эфиров, винил-сульфидов и виниламинов взаимодействия ацетилена со спиртами, фенолами, кислотами, меркаптанами
- 14. Механизм реакцииции включает стадию образования карбаниона (В-основание): В условиях Реппе реакции, используя в качестве катализаторов Zn-или
- 15. Конденсация ацетилена и его монозамещенных гомологов с альдегидами или кетонами (алкинолъный синтез), аминами (аминобутиновый синтез) или
- 16. В случае альдегидов (R' = Н) присоединение второй молекулы затрудняется с ростом длины углеводородной цепи. Аминобутиновый
- 17. Циклоолигомеризация ацетилена и его гомологов с образованием бензола, циклооктатетраена и их производных, а также циклополиолефинов более
- 18. Реакцию осуществляют при 60-120 °С и 1,5-2,5 МПа в органическом растворителе (бензоле, циклогексане, ТГФ, диоксане, ДМФА
- 19. http://www.xumuk.ru/encyklopedia/2/4688.html
- 21. Скачать презентацию

















 Периодический закон Д. Менделеева с точки зрения строения атома. Часть 1
Периодический закон Д. Менделеева с точки зрения строения атома. Часть 1 Искусство фотографии и химия
Искусство фотографии и химия Analysis of proteins
Analysis of proteins Задачи химической кинетики
Задачи химической кинетики Железо и его соединения
Железо и его соединения Алканы. Химические свойства. Применение
Алканы. Химические свойства. Применение Направление процесса. ОВР
Направление процесса. ОВР Синтез 7,7 - дихлоробицикло [4.1.0] гептана
Синтез 7,7 - дихлоробицикло [4.1.0] гептана Кремний и 4 группа. 9 класс
Кремний и 4 группа. 9 класс Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Пропитка рубинов и сапфиров
Пропитка рубинов и сапфиров Амины, азо- и диазосоединения (продолжение)
Амины, азо- и диазосоединения (продолжение) Газовые смеси. Способы задания газовых смесей. Лекция 5
Газовые смеси. Способы задания газовых смесей. Лекция 5 Структура периодической таблицы
Структура периодической таблицы Обобщение знаний по теме атомы химических элементов. Химическая связь
Обобщение знаний по теме атомы химических элементов. Химическая связь Презентация на тему Аминокислоты и белки: строение и свойства
Презентация на тему Аминокислоты и белки: строение и свойства  Железо в продуктах питания
Железо в продуктах питания Производство аммиака
Производство аммиака Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов
Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов kristallichekaya_reshenka_vidy
kristallichekaya_reshenka_vidy Кальций, железо. Горение стальной ваты и железного порошка
Кальций, железо. Горение стальной ваты и железного порошка Сравнение активностей металлов
Сравнение активностей металлов Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Презентация на тему Строение и свойства циклоалканов
Презентация на тему Строение и свойства циклоалканов  Кислоты с металлами
Кислоты с металлами Многообразие веществ
Многообразие веществ Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химическая кинетика. Основные понятия. Основы формальной кинетики
Химическая кинетика. Основные понятия. Основы формальной кинетики