Содержание
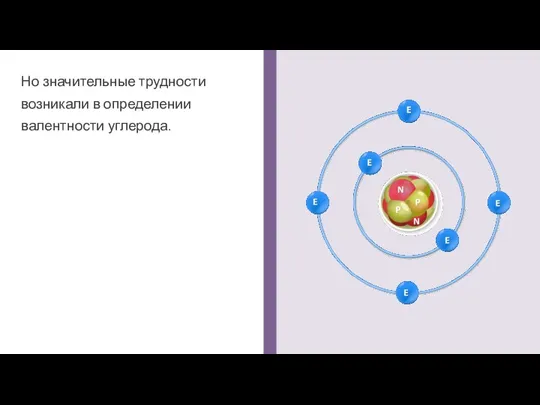
- 2. Но значительные трудности возникали в определении валентности углерода.
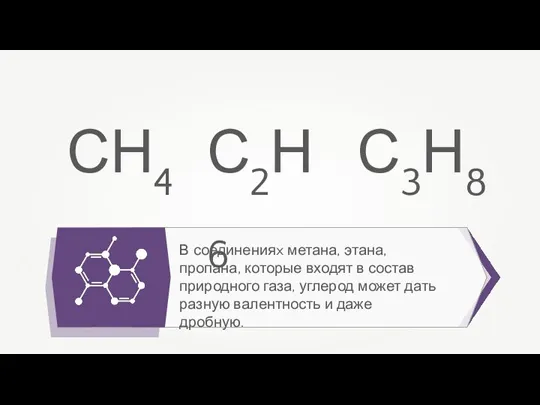
- 3. В соединенияx метана, этана, пропана, которые входят в состав природного газа, углерод может дать разную валентность
- 4. Согласно с современными электронными представлениями, все особенности органических соединений определяются свойствами элемента углерода.
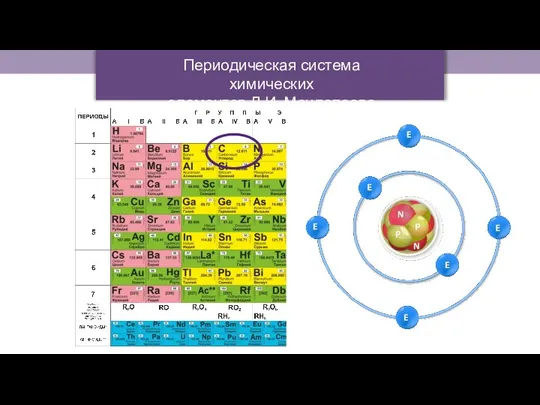
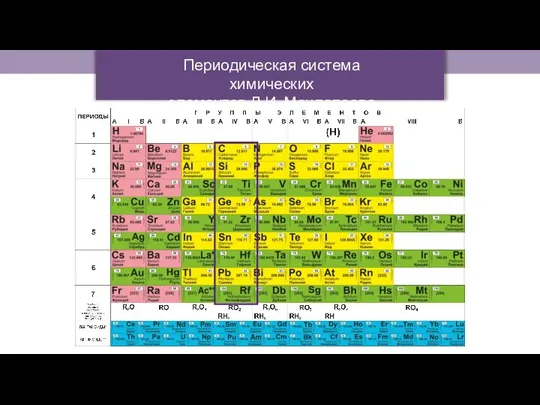
- 5. Периодическая система химических элементов Д.И. Менделеева
- 6. Периодическая система химических элементов Д.И. Менделеева
- 7. Углерод 1S22S22P2 В свободном состоянии 1S22S12P3 В возбуждённом состоянии E 2S 1S 2P E 2S 1S
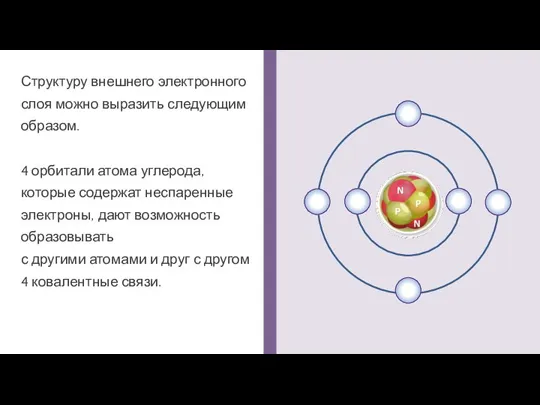
- 8. Структуру внешнего электронного слоя можно выразить следующим образом. 4 орбитали атома углерода, которые содержат неспаренные электроны,
- 9. Ковалентная связь (от латинского «со» — совместно и «vales» — имеющий силу) осуществляется за счёт электронной
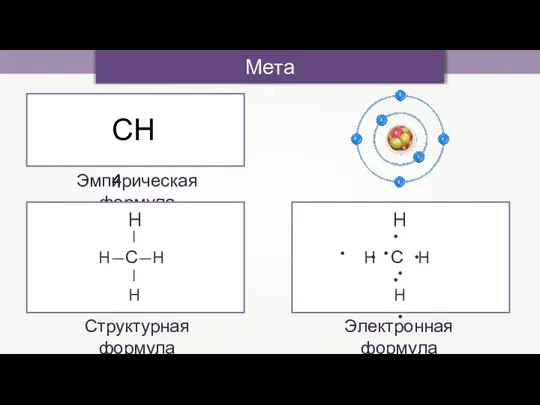
- 10. СН4 Метан Эмпирическая формула Структурная формула Электронная формула
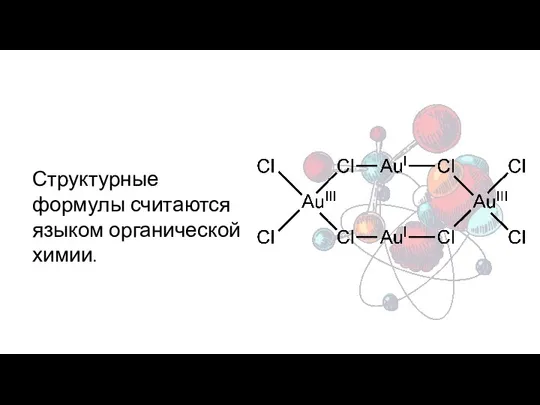
- 11. Структурные формулы считаются языком органической химии.
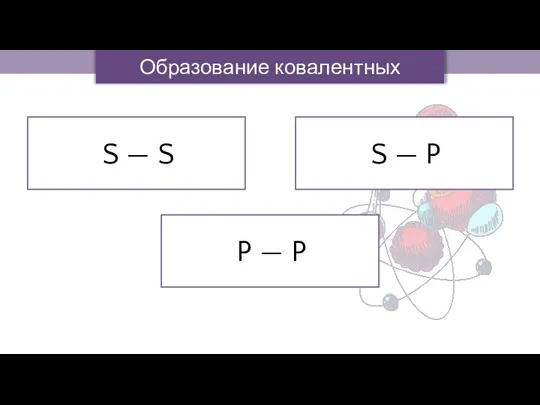
- 12. S — S S — P P — P Образование ковалентных связей
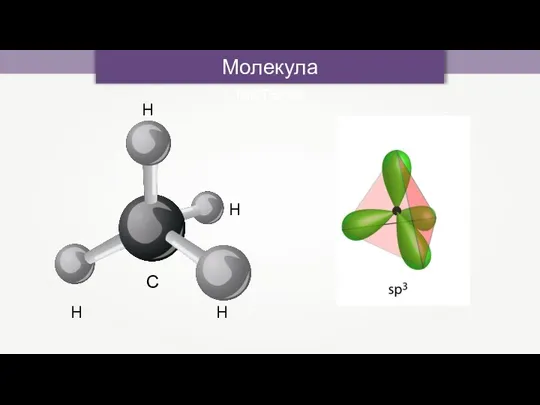
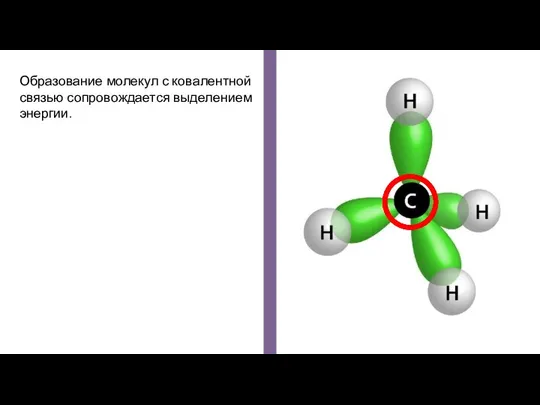
- 13. С H H H H Молекула метана
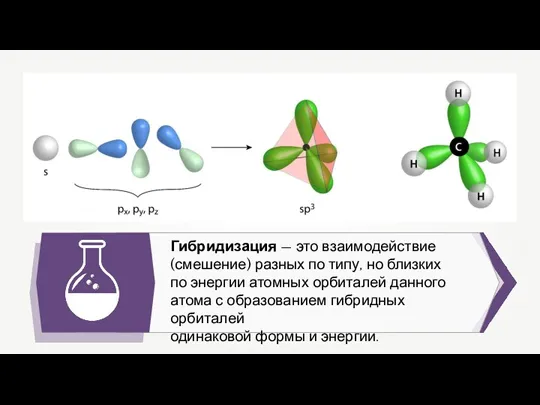
- 14. Гибридизация — это взаимодействие (смешение) разных по типу, но близких по энергии атомных орбиталей данного атома
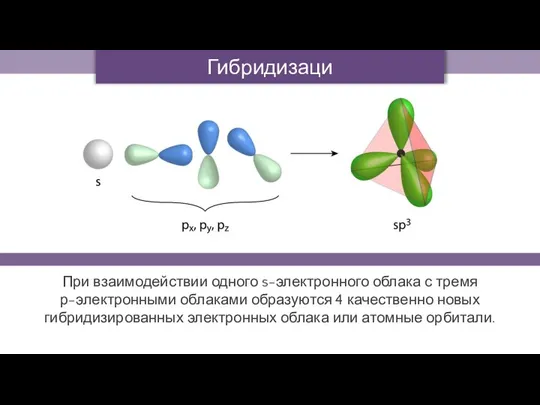
- 15. Гибридизация При взаимодействии одного s-электронного облака с тремя р-электронными облаками образуются 4 качественно новых гибридизированных электронных
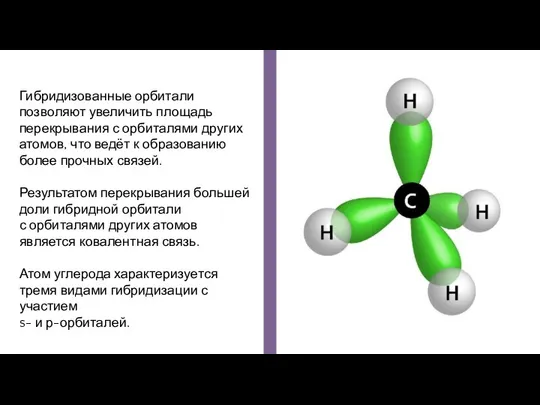
- 16. Гибридизованные орбитали позволяют увеличить площадь перекрывания с орбиталями других атомов, что ведёт к образованию более прочных
- 17. Образование молекул с ковалентной связью сопровождается выделением энергии.
- 18. Энергия связи указывает на его прочность и измеряется в килоджоулях на 1 моль. кДж/моль
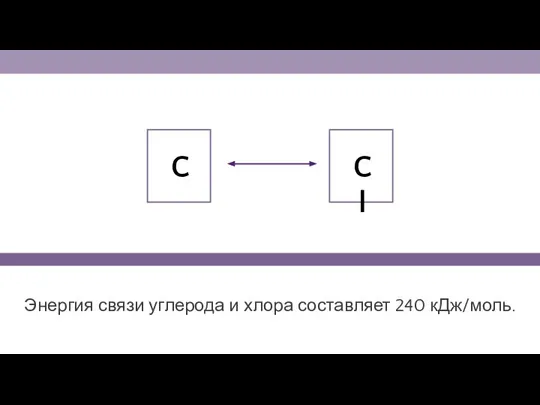
- 19. Энергия связи углерода и хлора составляет 240 кДж/моль. C Cl
- 21. Скачать презентацию




 Сучкова Н.В. учитель химии первой квалификационной категории 2008-2009 учебный год
Сучкова Н.В. учитель химии первой квалификационной категории 2008-2009 учебный год Презентация на тему Органическая химия. Жиры
Презентация на тему Органическая химия. Жиры  Решение расчетных задач по химии
Решение расчетных задач по химии Органическая химия. Получение альдегидов и кетонов
Органическая химия. Получение альдегидов и кетонов Химия. 8 класс. Подготовка к контрольной работе
Химия. 8 класс. Подготовка к контрольной работе Хелатный эффект. Лекция 7
Хелатный эффект. Лекция 7 Влияние растворителей на скорость органических реакций. (Лекция 10)
Влияние растворителей на скорость органических реакций. (Лекция 10) Спирты
Спирты Основы химической термодинамики
Основы химической термодинамики Кислород
Кислород Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Классы неорганических соединений
Классы неорганических соединений Презентация на тему Электролиты
Презентация на тему Электролиты  Бор и его соединения
Бор и его соединения Пиримидин (шестичленный гетероцикл с двумя атомами азота)
Пиримидин (шестичленный гетероцикл с двумя атомами азота) Эмульсии как лиофобные дисперсные системы
Эмульсии как лиофобные дисперсные системы Материальные и энергетические балансы. Тема 2
Материальные и энергетические балансы. Тема 2 Диэлектрики
Диэлектрики Презентация на тему Всё о кремнии
Презентация на тему Всё о кремнии  Химическая связь. Описание ковалентной химической связи методом молекулярных орбиталей
Химическая связь. Описание ковалентной химической связи методом молекулярных орбиталей Термохимия. Закон Гесса. Следствия из закона Гесса
Термохимия. Закон Гесса. Следствия из закона Гесса Предельные углеводороды. Алканы (1)
Предельные углеводороды. Алканы (1) Химический элемент. Изотопы. Ионы
Химический элемент. Изотопы. Ионы Изомерия. Виды изомерии
Изомерия. Виды изомерии Химия крови. Диффузия, тургор, осмос в клетке
Химия крови. Диффузия, тургор, осмос в клетке Классы неорганических веществ. Оксиды
Классы неорганических веществ. Оксиды Պոլիմերներ
Պոլիմերներ Свойства неметаллов и их соединений
Свойства неметаллов и их соединений