Содержание
- 2. Thermo – тепло Термохимия вокруг: ДВС, турбины, плиты История: огонь, термоеда, обогрев (и охлаждение!) Тепло и
- 3. Thermo – ТЕРМО... [от греч. thermē тепло, жар] Первая часть сложных слов: 1.Относящийся к теплоте, температуре.
- 4. ТЕРМО... в химии ТЕРМОХИМИЯ, раздел физической химии, изучающий ТЕПЛОВЫЕ эффекты, сопровождающие химические процессы: выделение или поглощение
- 5. ТЕРМО... в химии В широкой трактовке Большинство реакций протекают под действием тепла Кроме фотохимических, радиационно-химических, механохимических)
- 6. Термохимия вокруг: ДВС, турбины, плиты И многое, многое другое
- 7. История: огонь, термоеда, обогрев (и охлаждение!)
- 8. Тепло и холод Попробуйте определить эти понятия Почему t = 0°C, но T = 273 K?
- 9. Что такое Т = 0 К? Может ли быть Т
- 10. Теория теплорода (Лавуазье) XXVIII – начало XIX века Чем больше теплорода в веществе, тем оно теплее.
- 11. Опыт Б. Томсона (графа Румфорда) 1798 Б. Томсон (гр. Румфорд) 1753 - 1814
- 12. Опыт Х. Дэви с трением льда 1799 Х. Дэви 1778 - 1829
- 13. 20 °С = 36 °F = 16 °R
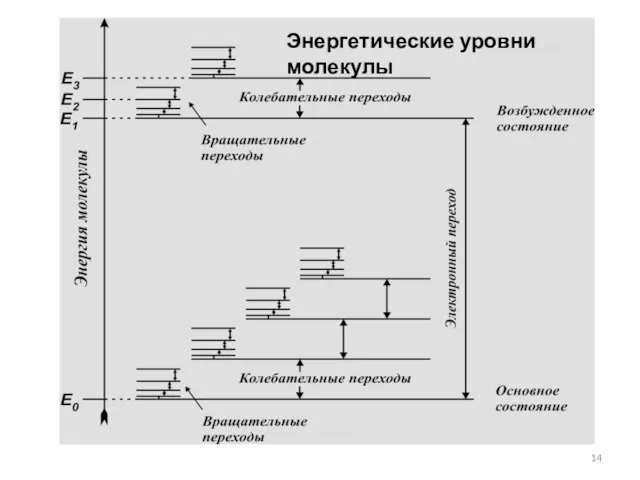
- 14. Энергетические уровни молекулы
- 15. E(пост.) = 3×(1/2) ×kT E(вращ.) = 3×(1/2) ×kT E(кол.) = i×kT ~ Т E(тепл.) = E(пост.)
- 16. Если кажется, что вам холодно – это неправда! Просто вам недостаточно тепло. В науке есть только
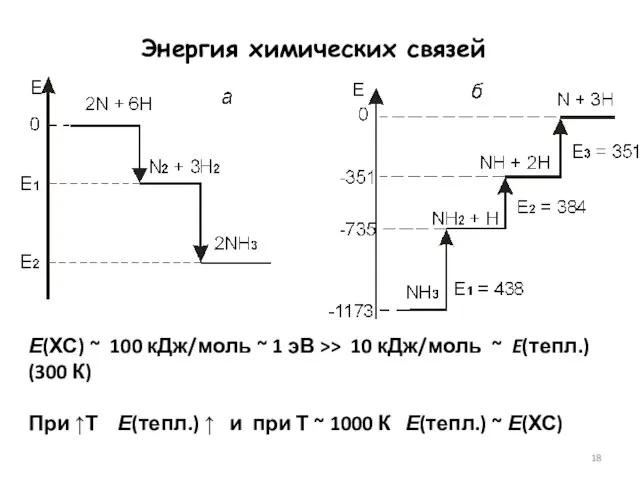
- 18. Е(ХС) ~ 100 кДж/моль ~ 1 эВ >> 10 кДж/моль ~ E(тепл.) (300 К) При ↑Т
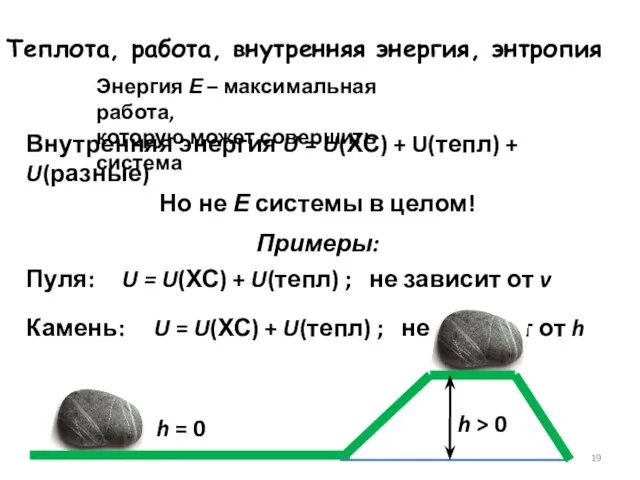
- 19. Теплота, работа, внутренняя энергия, энтропия Энергия Е – максимальная работа, которую может совершить система Внутренняя энергия
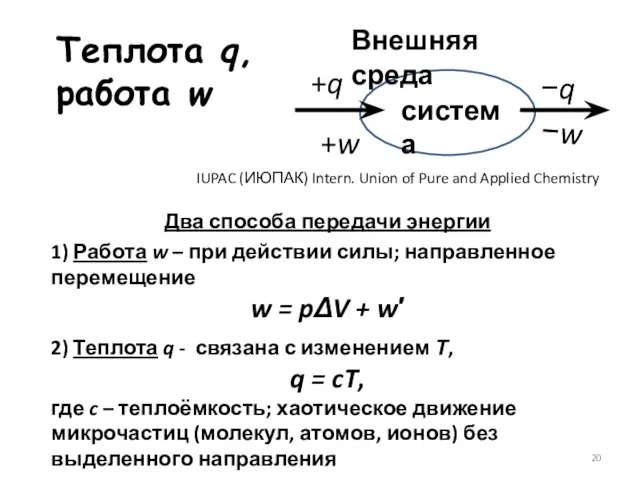
- 20. Теплота q, работа w Два способа передачи энергии 1) Работа w – при действии силы; направленное
- 21. система Внешняя среда +q −q +w −w 1-е начало термодинамики ΔU = q + w q
- 22. Энтальпия H = U + pV ΔH = ΔU + рΔV = Qp при p =
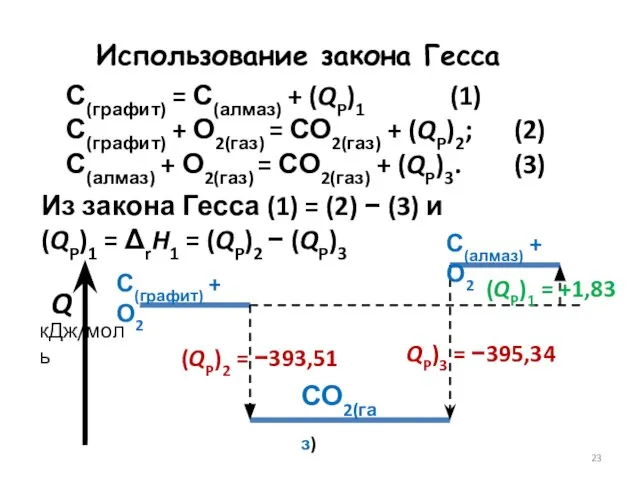
- 23. С(графит) = С(алмаз) + (QP)1 (1) С(графит) + О2(газ) = СО2(газ) + (QP)2; (2) С(алмаз) +
- 24. Энтропия S = Δq/T S = k×lnΩ Δ S ≥ Δq/T Δ S = Δq/T при
- 25. 1 2 3 Ω = 3 Ω = 1 S = k×ln1 = 0 S =
- 26. Невозможна самопроизвольная передача теплоты от холодного тела к теплому. Клаузиус лед тает, а не наоборот при
- 27. Энтропия Вселенной как замкнутой системы стремится к максимуму, и в конце концов во Вселенной закончатся все
- 28. Вопрос: Возможно ли состояние, при котором все молекулы воздуха окажутся в одной половине аудитории, или это
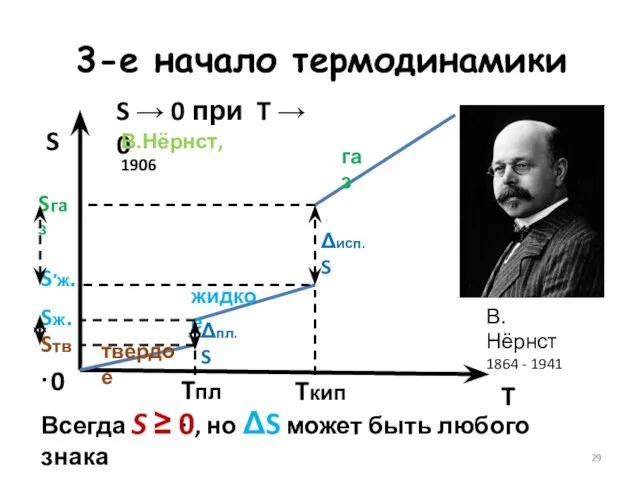
- 29. 3-е начало термодинамики S T Tпл. Tкип. 0 твердое жидкое газ S → 0 при T
- 30. 1 – Энергия Вселенной постоянна 2 – Энтропия Вселенной стремится к максимуму А. Зоммерфельд: Закон сохранения
- 31. Объединение 1-го и 2-го начала Энергия (функция) Гиббса G = H - TS ΔrG = ΔrG°
- 32. Критерии равновесия для изобарно-изотермических процессов Дж. Гиббс 1839 - 1903
- 33. lnK = –ΔrG° / RT = –ΔrH° / RT + ΔrS° / R lnK = А
- 34. 2NaHCO3(тв.) + SO2(газ) = Na2SO3(тв.) + 2CO2(газ) + H2O(газ) КС = [SO3]2 / [SO2]2 · [O2];
- 35. «гептил» – несимм. диметил гидразин H CH3 N N H CH3 6NH4ClO4 + 10Al = 3N2
- 36. Изменение формы кристалла Y2(C2O4)3*10H2O при дегидратации на воздухе Реакция Y2(C2O4)3*10H2O = Y2(C2O4)3*6H2O + 4H2O(газ)
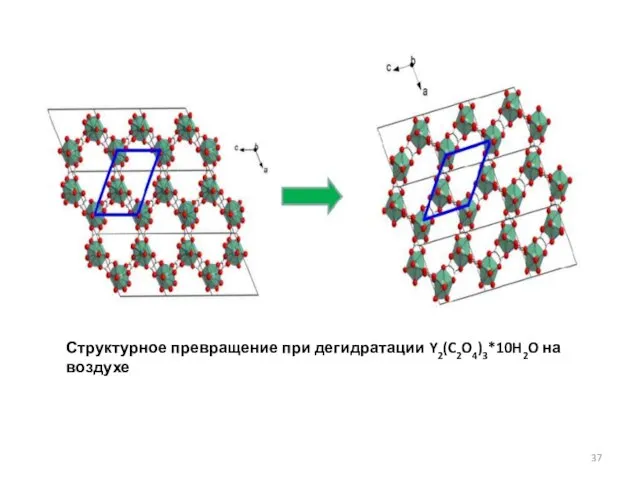
- 37. Структурное превращение при дегидратации Y2(C2O4)3*10H2O на воздухе
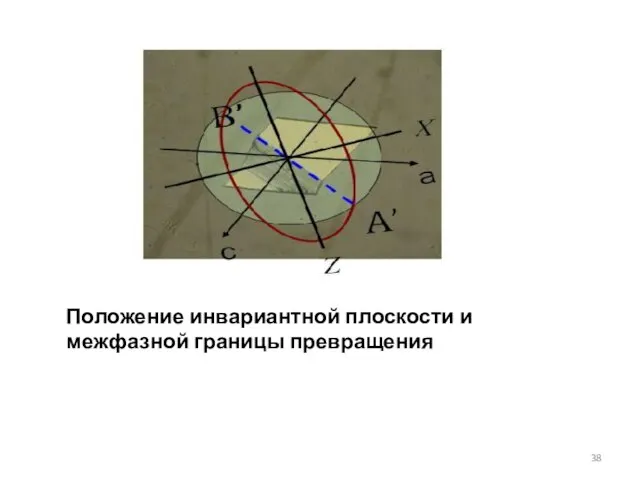
- 38. Положение инвариантной плоскости и межфазной границы превращения
- 39. Изменние формы кристалла Y2(C2O4)3*10H2O при дегидратации при повышенной влажности
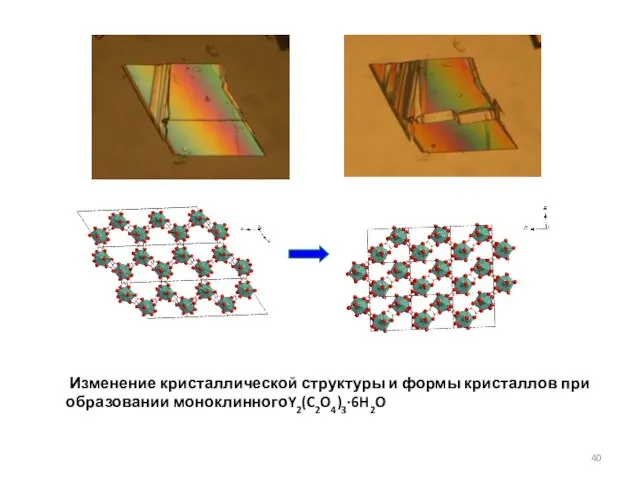
- 40. Изменение кристаллической структуры и формы кристаллов при образовании моноклинногоY2(C2O4)3∙6H2O
- 42. Скачать презентацию

![Thermo – ТЕРМО... [от греч. thermē тепло, жар] Первая часть сложных слов:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/851676/slide-2.jpg)























![2NaHCO3(тв.) + SO2(газ) = Na2SO3(тв.) + 2CO2(газ) + H2O(газ) КС = [SO3]2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/851676/slide-33.jpg)



 Увлекательный мир науки и практики
Увлекательный мир науки и практики Лакмусовые бумажки из сока краснокочанной капусты
Лакмусовые бумажки из сока краснокочанной капусты Распределение электронов в атомах
Распределение электронов в атомах Презентация на тему Дисперсные системы (11 класс)
Презентация на тему Дисперсные системы (11 класс)  Химическая связь
Химическая связь Аэрозоли и аэродисперсии
Аэрозоли и аэродисперсии К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Альдегиды и кетоны
Альдегиды и кетоны Основы химической кинетики
Основы химической кинетики Альдегиды. Свойства альдегидов
Альдегиды. Свойства альдегидов Создание учебно-методических материалов по химии в современной форме (презентации уроков)
Создание учебно-методических материалов по химии в современной форме (презентации уроков) Презентация на тему Карбонаты
Презентация на тему Карбонаты  Альдегиды. Строение молекул
Альдегиды. Строение молекул Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя
Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя  Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері
Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері Оксиды. Сложные вещества
Оксиды. Сложные вещества Кальций как химический элемент
Кальций как химический элемент Использование культурологического компонента на уроках химии
Использование культурологического компонента на уроках химии Изотопы. Области применения изотопов
Изотопы. Области применения изотопов Фосфор в организме человека
Фосфор в организме человека Зависимость скорости от температуры
Зависимость скорости от температуры Легированные стали
Легированные стали Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Алюминий. 9 класс
Алюминий. 9 класс Алюминийорганические соединения
Алюминийорганические соединения Тест по химии. ГИА
Тест по химии. ГИА Химия и косметика
Химия и косметика