Содержание
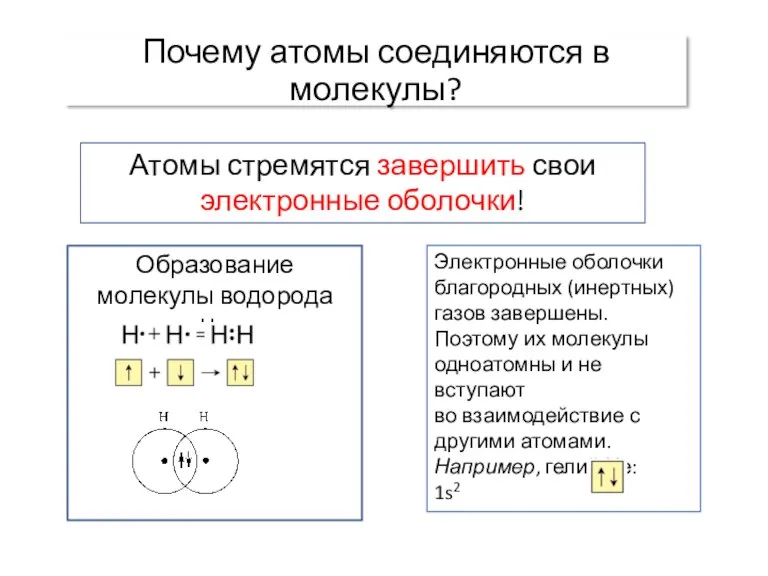
- 2. Почему атомы соединяются в молекулы? Атомы стремятся завершить свои электронные оболочки! Образование молекулы водорода H2: Электронные
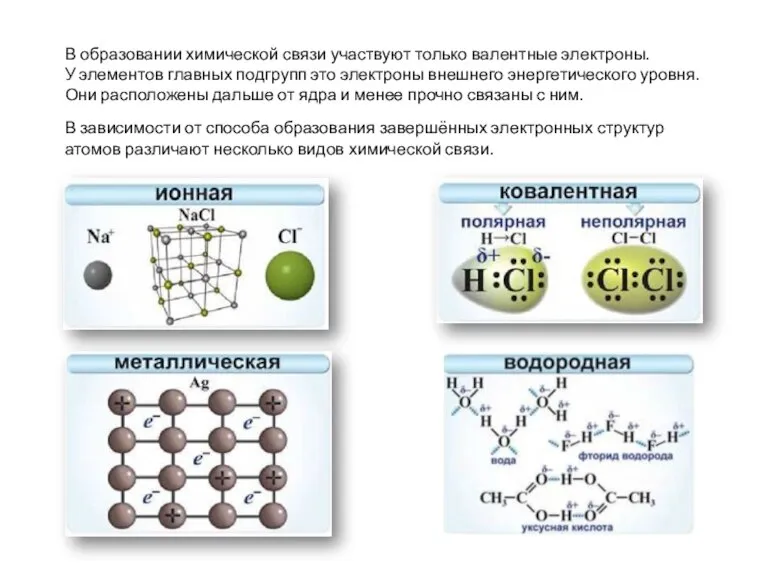
- 3. В образовании химической связи участвуют только валентные электроны. У элементов главных подгрупп это электроны внешнего энергетического
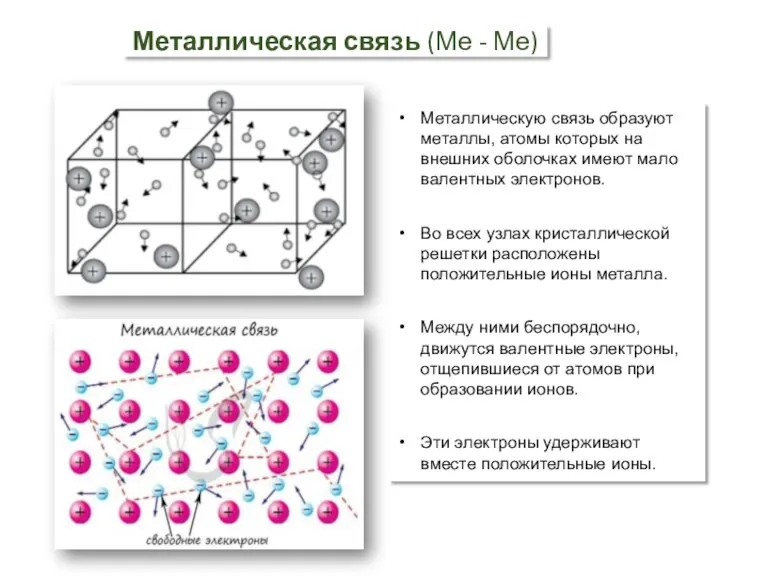
- 4. Металлическая связь (Ме - Ме) Металлическую связь образуют металлы, атомы которых на внешних оболочках имеют мало
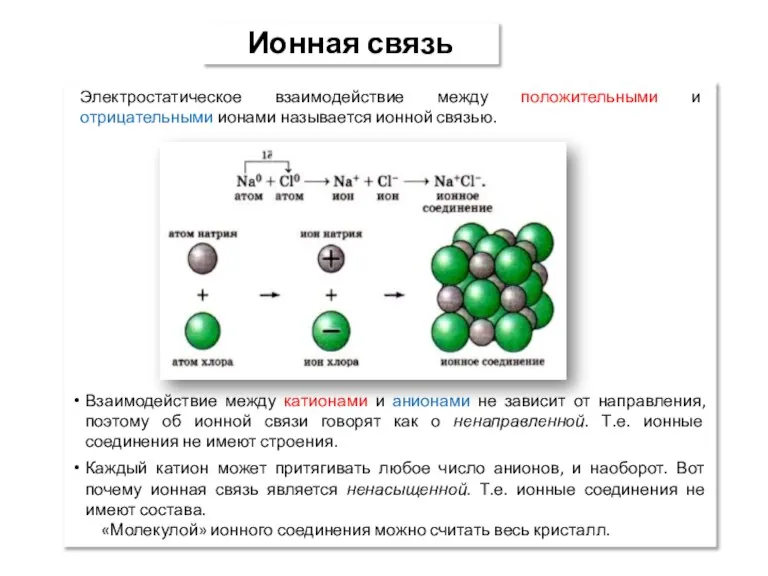
- 5. Ионная связь Электростатическое взаимодействие между положительными и отрицательными ионами называется ионной связью. Взаимодействие между катионами и
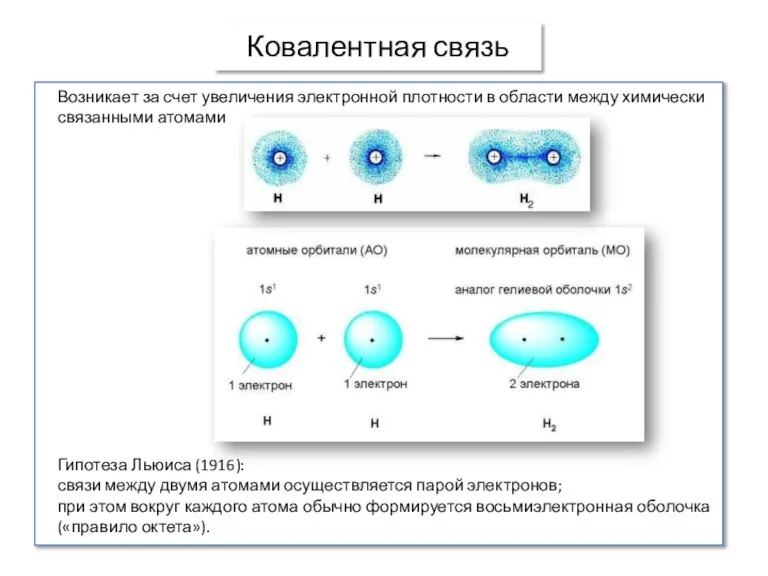
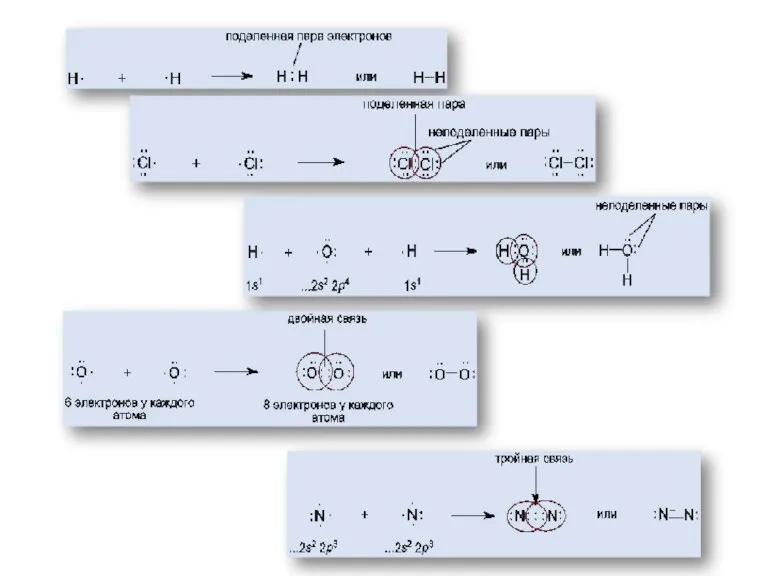
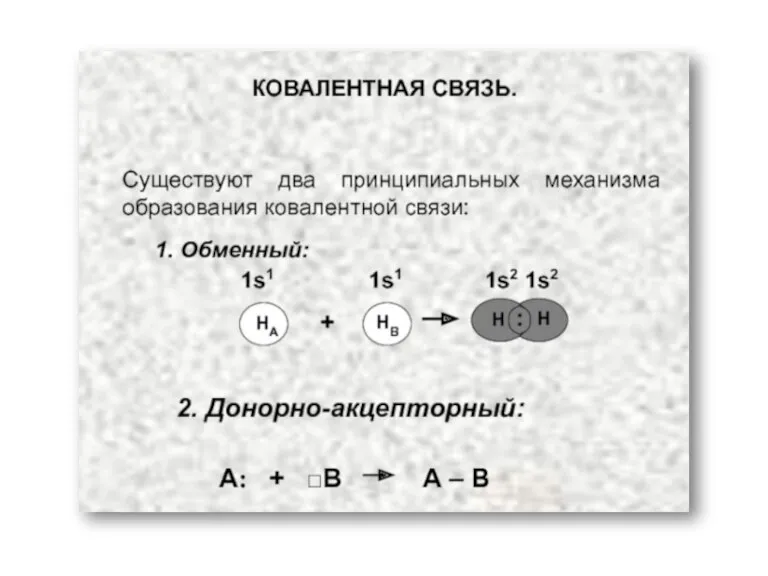
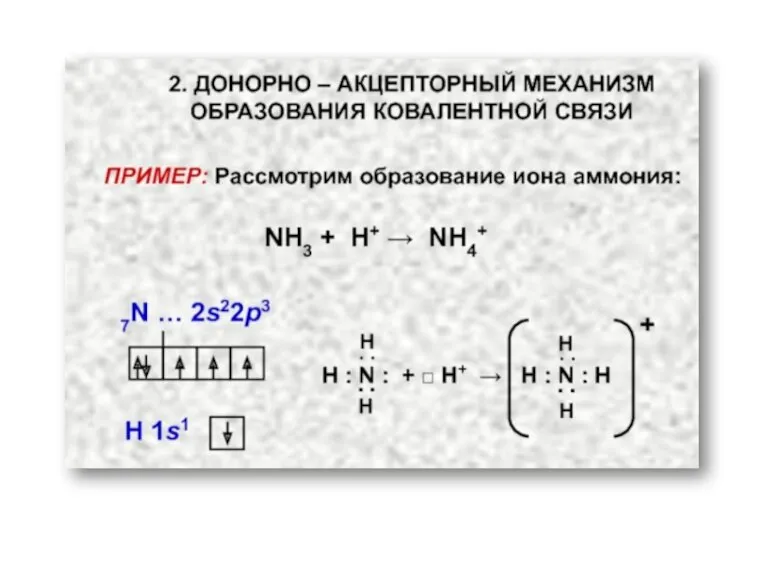
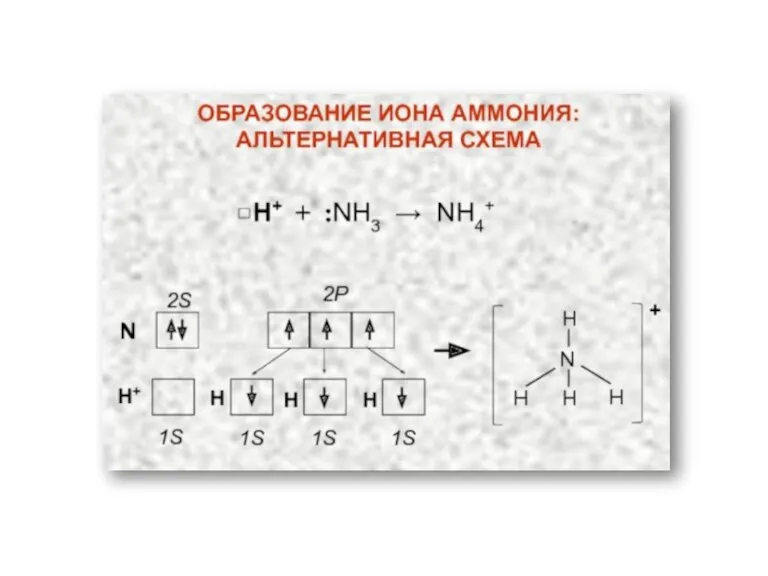
- 7. Ковалентная связь Возникает за счет увеличения электронной плотности в области между химически связанными атомами Гипотеза Льюиса
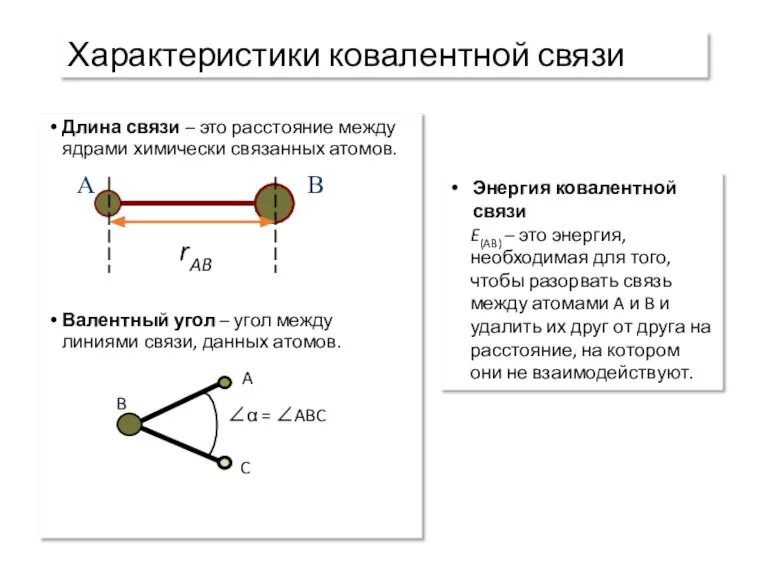
- 9. Характеристики ковалентной связи Длина связи – это расстояние между ядрами химически связанных атомов. Валентный угол –
- 10. Свойства ковалентной связи Валентность – это свойство одиночного атома к образованию того или иного числа ковалентных
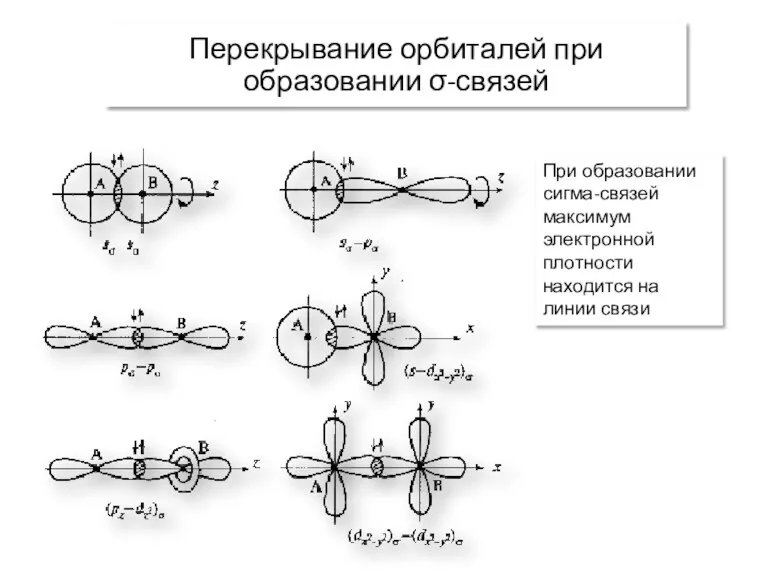
- 11. Перекрывание орбиталей при образовании σ-связей При образовании сигма-связей максимум электронной плотности находится на линии связи
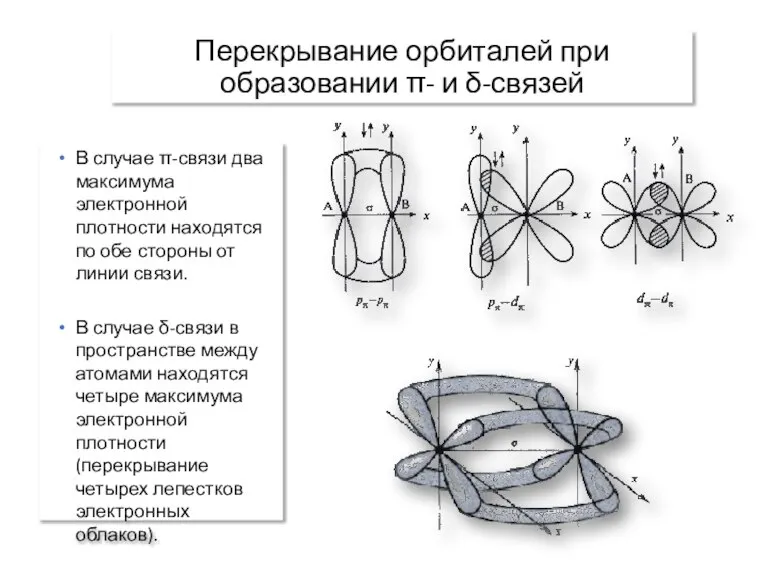
- 12. Перекрывание орбиталей при образовании π- и δ-связей В случае π-связи два максимума электронной плотности находятся по
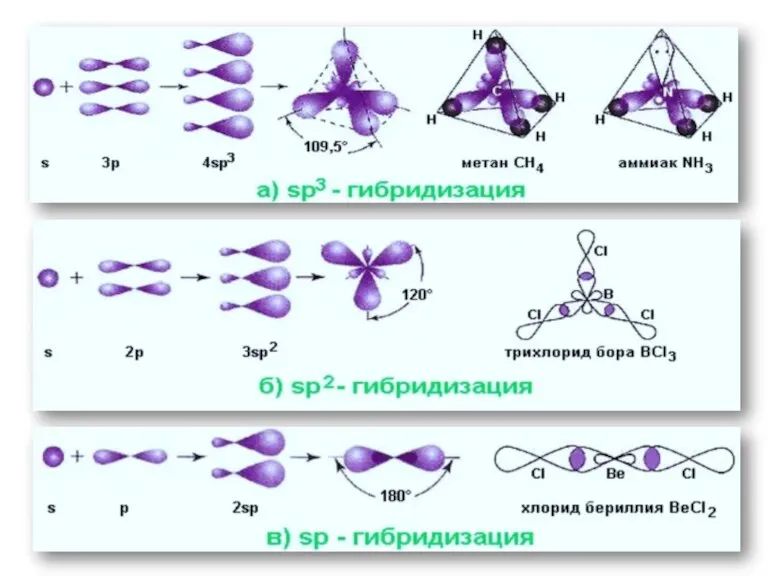
- 16. Гибридизация атомных орбиталей Гибридизация – это выравнивание (усреднение) энергетических и геометрических характеристик атомных орбиталей разных подуровней
- 17. Примеры гибридизации Be: [He]2s2 Be*: [He]2s12p1 s-АО + p-АО = 2sp-АО
- 18. Примеры гибридизации B: [He]2s22p1 B*: [He]2s12p2
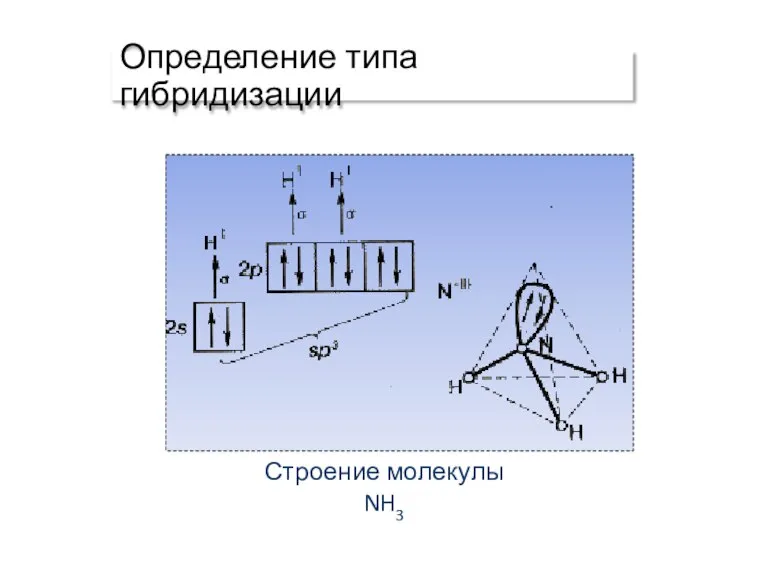
- 20. Определение типа гибридизации Строение молекулы NH3
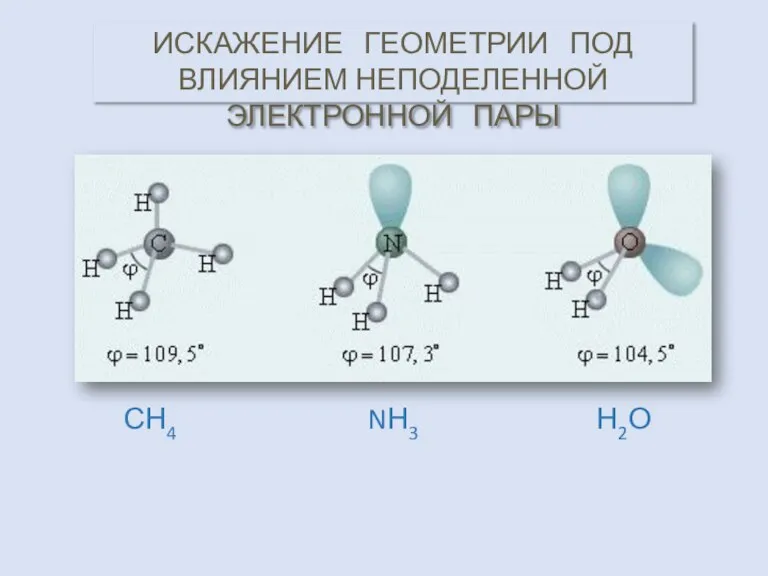
- 21. Н2О NН3 СН4 ИСКАЖЕНИЕ ГЕОМЕТРИИ ПОД ВЛИЯНИЕМ НЕПОДЕЛЕННОЙ ЭЛЕКТРОННОЙ ПАРЫ
- 23. Скачать презентацию



![Примеры гибридизации Be: [He]2s2 Be*: [He]2s12p1 s-АО + p-АО = 2sp-АО](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1150470/slide-16.jpg)
![Примеры гибридизации B: [He]2s22p1 B*: [He]2s12p2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1150470/slide-17.jpg)
 Метиловый спирт
Метиловый спирт Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6
Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6 Техника титрования и лабораторная посуда
Техника титрования и лабораторная посуда Гибридизация
Гибридизация Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу
Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу Оценивание эффективности многофункциональной присадки для бензинов
Оценивание эффективности многофункциональной присадки для бензинов Общая характеристика оксидов
Общая характеристика оксидов Алкадиены. Каучук. История открытия каучука
Алкадиены. Каучук. История открытия каучука Нихром. Физические свойства
Нихром. Физические свойства Алкадиены: номенклатуры, изомерия. Тест
Алкадиены: номенклатуры, изомерия. Тест Щелочно-земельные металлы и магний
Щелочно-земельные металлы и магний Характеристика кислорода как химического элемента и простого вещества
Характеристика кислорода как химического элемента и простого вещества Свойства химической связи
Свойства химической связи Л1.4. Диаграмма железо-углерод
Л1.4. Диаграмма железо-углерод Презентация на тему Ковалентная неполярная связь
Презентация на тему Ковалентная неполярная связь 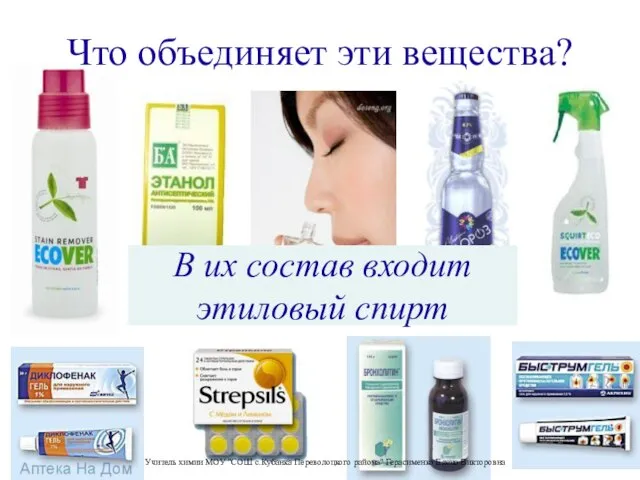 Презентация на тему Этиловый спирт и его влияние на здоровье человека
Презентация на тему Этиловый спирт и его влияние на здоровье человека  Алканы: гомологический ряд, строение, номенклатура, физические свойства
Алканы: гомологический ряд, строение, номенклатура, физические свойства Порядок в жидкостях
Порядок в жидкостях Молярная масса вещества
Молярная масса вещества Презентация на тему Общая жесткость воды
Презентация на тему Общая жесткость воды  Химические свойства оснований
Химические свойства оснований День химии
День химии Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем
Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем Вывод и обсуждение
Вывод и обсуждение Кристаллические решетки
Кристаллические решетки Углеводы: моно-, олиго- и полисахариды
Углеводы: моно-, олиго- и полисахариды Презентация на тему Химическая связь (8 класс)
Презентация на тему Химическая связь (8 класс)  Химический футбол на тему: Химия вокруг нас
Химический футбол на тему: Химия вокруг нас