Содержание
- 2. Изучить тему по ссылкам: http://ru.solverbook.com/spravochnik/ximiya/11-klass/amfoternye-organicheskie-i-neorganicheskie-soedineniya/ https://www.youtube.com/watch?v=-_EQTpNTRs0
- 3. Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водорода
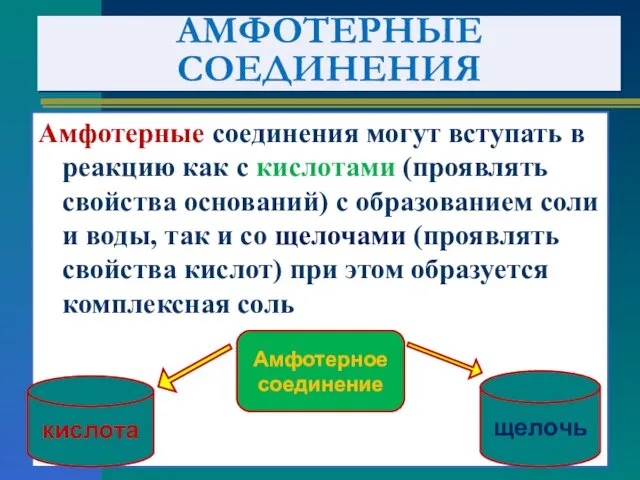
- 4. АМФОТЕРНЫЕ СОЕДИНЕНИЯ Амфотерные соединения могут вступать в реакцию как с кислотами (проявлять свойства оснований) с образованием
- 5. Амфотерные соединения Такими являются в неорганической химии: Аl(ОН)3, Zn(ОН)2, Cr(ОН)3, Ве(ОН)2, Gе(ОН)2, Sn(ОН)4, Pb(ОН)2 и др.
- 6. В реакциях с кислотами амфотерные оксиды ведут себя как основные оксиды Например: Аl2О3 + 6НСl =
- 7. Амфотерные гидроксиды взаимодействуют с растворами кислот и ведут себя как нерастворимые основания Аl(ОН)3 + ЗНСl =
- 8. Свойства аминокислот NH2 – CH – C O OH R Аминогруппа, – NH2 – акцептор водорода,
- 9. Кислотные свойства аминокислот NH2 – R – COOH + NaOH = NH2 – R – COONa
- 10. Основные свойства аминокислот COOH – R – NH2 + HCl = COOH – R – NH3
- 12. Скачать презентацию








 Строение атома
Строение атома Презентация на тему Физические и химические явления
Презентация на тему Физические и химические явления  Окислительно - восстановительные свойства серной кислоты
Окислительно - восстановительные свойства серной кислоты Общая характеристика элементов главной подгруппы II группы
Общая характеристика элементов главной подгруппы II группы Повторение по теме: « Химическая связь. Строение вещества». Виды химических связей Типы кристаллических
Повторение по теме: « Химическая связь. Строение вещества». Виды химических связей Типы кристаллических Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Электролиз расплавов и растворов электролитов
Электролиз расплавов и растворов электролитов Метод окислительно - восстановительного титрования
Метод окислительно - восстановительного титрования Презентация на тему Каучук
Презентация на тему Каучук  Фенол. Классификация фенолов
Фенол. Классификация фенолов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Валентность
Валентность Основы молекулярно - кинетической теории
Основы молекулярно - кинетической теории Общие химические свойства металлов
Общие химические свойства металлов Выделение и модификация древесных полимеров с получением биоактивных полимеров и матриц
Выделение и модификация древесных полимеров с получением биоактивных полимеров и матриц Витамины. Способы получения
Витамины. Способы получения Алкены
Алкены Свойства воды. Физические свойства
Свойства воды. Физические свойства Высшие жирные кислоты липиды
Высшие жирные кислоты липиды Personal сare. Akypo Foam Rl 40
Personal сare. Akypo Foam Rl 40 Электрохимия. Электролиты
Электрохимия. Электролиты Основания. Классификация
Основания. Классификация Соль. Добыча соли
Соль. Добыча соли Химия. Ребусы
Химия. Ребусы Золото. Золотые сплавы
Золото. Золотые сплавы Применение алкенов
Применение алкенов Презентация на тему Спирты
Презентация на тему Спирты  Фосфор
Фосфор