Повторение по теме: « Химическая связь. Строение вещества». Виды химических связей Типы кристаллических
Содержание
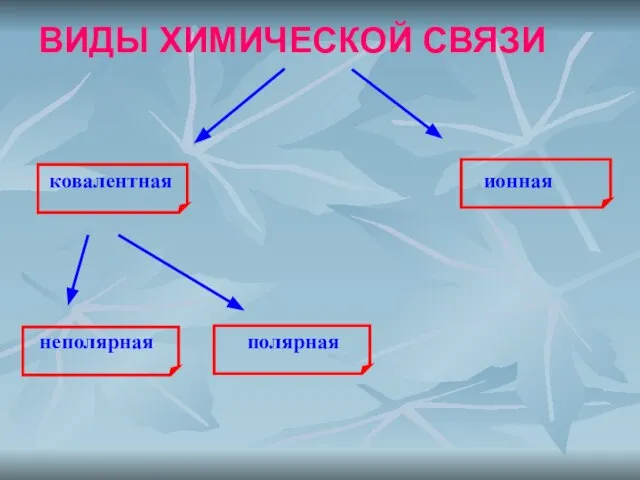
- 2. ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ
- 3. Охарактеризуйте виды химических связей К.Н.С. - это … К.П.С. - это … И.С. - это …
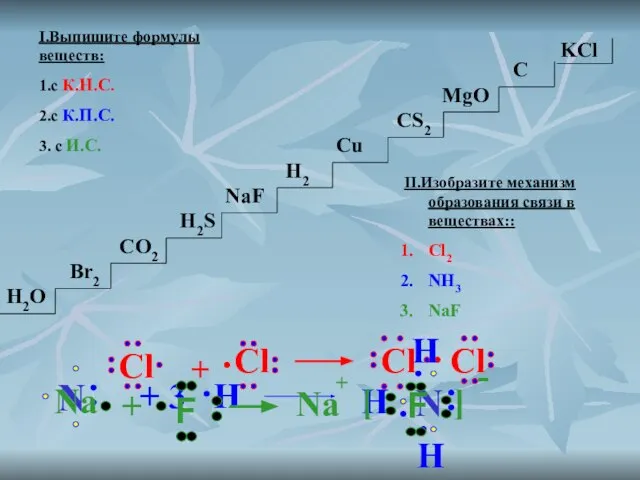
- 4. I.Выпишите формулы веществ: 1.с К.Н.С. 2.с К.П.С. 3. с И.С. H2O Br2 CO2 H2S H2 NaF
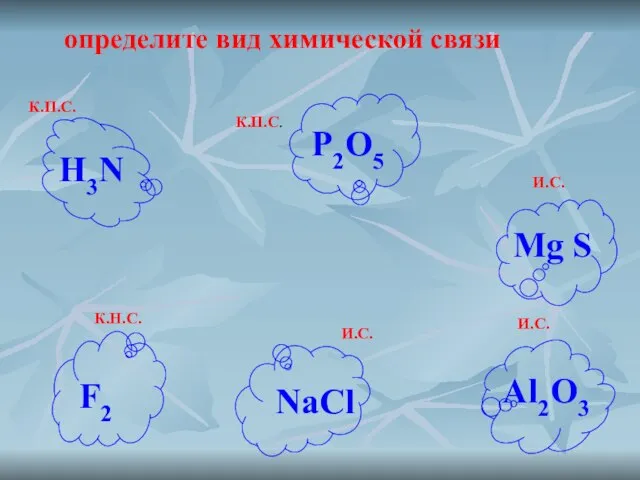
- 5. определите вид химической связи К.П.С. К.П.С. И.С. И.С. К.Н.С. И.С. H3N P2O5 Mg S Al2O3 F2
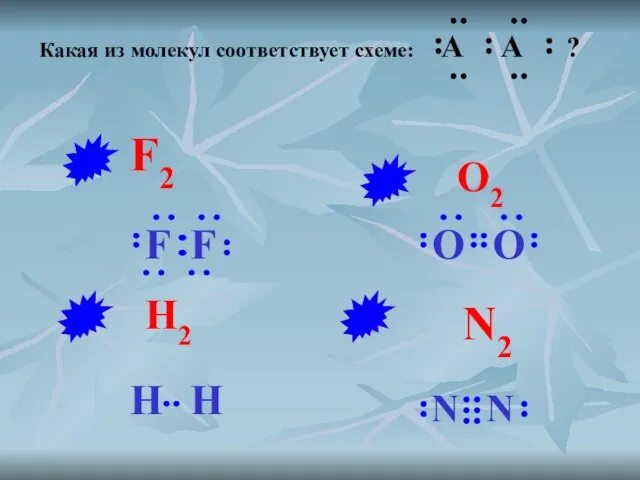
- 6. Какая из молекул соответствует схеме: A A ? N2 O2 H2 F2
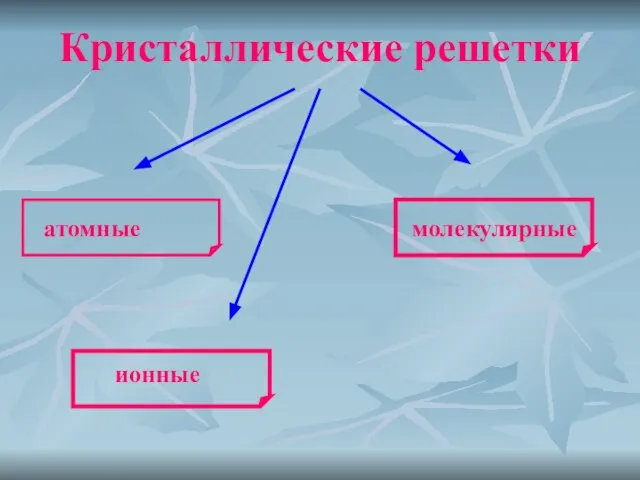
- 7. Кристаллические решетки
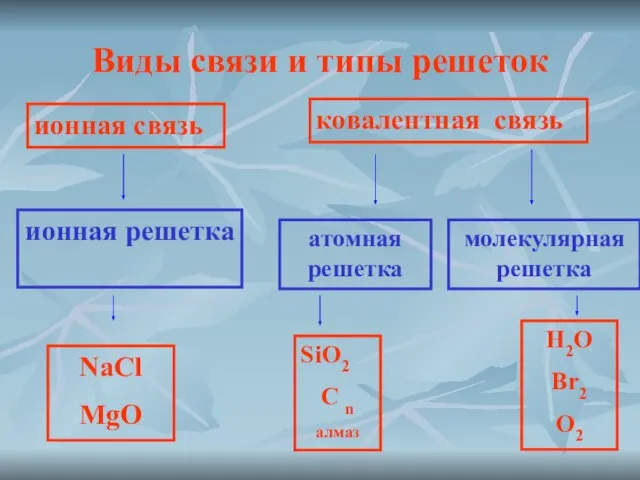
- 8. Виды связи и типы решеток ионная связь ионная решетка ковалентная связь атомная решетка молекулярная решетка SiO2
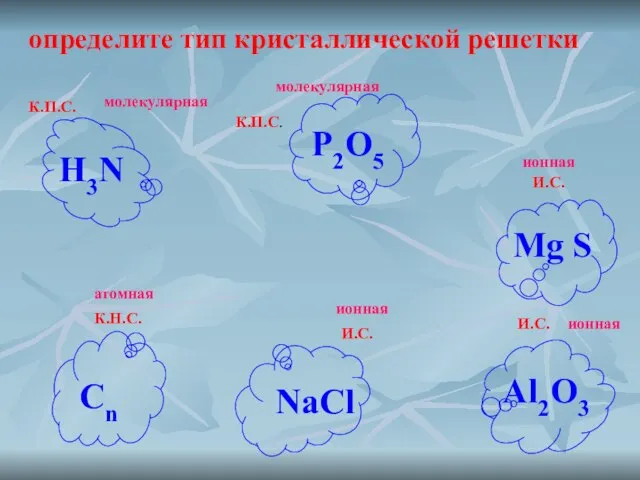
- 9. определите тип кристаллической решетки К.П.С. К.П.С. И.С. И.С. К.Н.С. И.С. H3N P2O5 Mg S Al2O3 Сn
- 10. степень окисления Дайте определение степени окисления Окислительно-восстановительная реакция Окисление Восстановление Окислитель Восстановитель
- 11. НЕТ НЕТ какая реакция является окислительно-восстановительной? H2SO4 +Na2O Na2SO4 + H2O SO3 + H2O H2SO4 2SO2
- 12. НЕТ НЕТ НЕТ Определите в каком веществе степень окисления серы равна +4 Н2S H2SO4 SO3 SO2
- 13. 3 1 2 4 ok нет нет нет Какой коэффициент перед формулой окислителя? Al + O2
- 14. 3 1 2 5 ok нет нет нет Какой коэффициент перед формулой восстановителя? P + Cl2
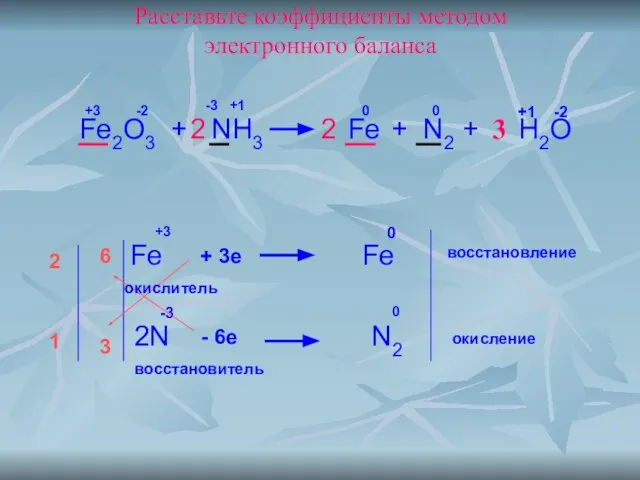
- 15. Расставьте коэффициенты методом электронного баланса Fe2O3 + NH3 Fe + N2 + H2O 0 0 +3
- 17. Скачать презентацию






 Аспирин и его влияние на организм человека
Аспирин и его влияние на организм человека Презентация на тему Обобщение по типам химических реакций
Презентация на тему Обобщение по типам химических реакций  Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Капроновая (гексановая) кислота
Капроновая (гексановая) кислота Заманауи косметика биотехнологиясы
Заманауи косметика биотехнологиясы ОГЭ №2, вопрос 1-16
ОГЭ №2, вопрос 1-16 Алкадиены. Строение. свойства и применение
Алкадиены. Строение. свойства и применение Спирты
Спирты минералы_4_блеск
минералы_4_блеск Prezentatsia_k_uroku
Prezentatsia_k_uroku Производство серной кислоты
Производство серной кислоты Александрит
Александрит Алюминий
Алюминий Арены. Бензол
Арены. Бензол Типы химической связи и кристаллических решеток
Типы химической связи и кристаллических решеток Альдегиды. Строение молекул
Альдегиды. Строение молекул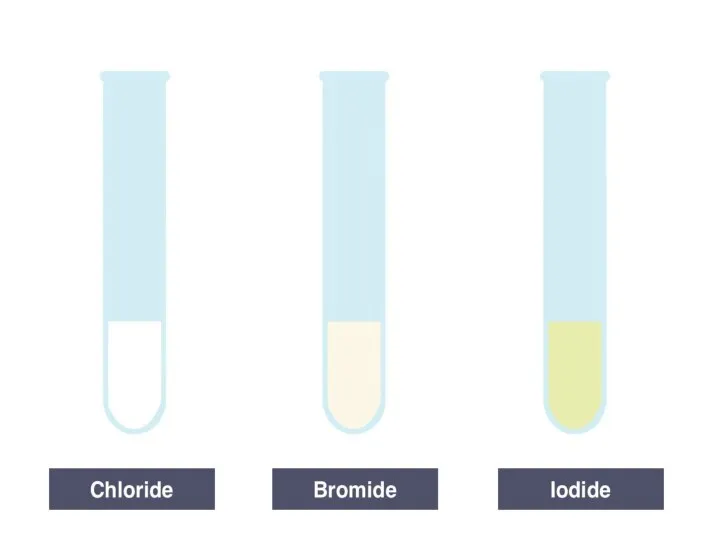 Определение галогенид-ионов в водном растворе. Лабораторный опыт
Определение галогенид-ионов в водном растворе. Лабораторный опыт Презентация на тему Химические свойства многоатомных спиртов
Презентация на тему Химические свойства многоатомных спиртов  Химические свойства солей
Химические свойства солей Классификация органических соединений. 10 класс
Классификация органических соединений. 10 класс Этапы приготовления и микроскопического исследования нативного препарата осадка мочи
Этапы приготовления и микроскопического исследования нативного препарата осадка мочи Избранные главы органической стереохимии
Избранные главы органической стереохимии Подготовка проб товаров к анализу. Химико-аналитический контроль
Подготовка проб товаров к анализу. Химико-аналитический контроль Первый закон термодинамики. Термохимия
Первый закон термодинамики. Термохимия Углеводы: моно-, олиго- и полисахариды
Углеводы: моно-, олиго- и полисахариды Альдегиды. Общая формула
Альдегиды. Общая формула Алкалоидтар. Алкалоидтарға жалпы сипаттама, жіктелуінің негізгі принциптері
Алкалоидтар. Алкалоидтарға жалпы сипаттама, жіктелуінің негізгі принциптері Классификация реакций. Таблица
Классификация реакций. Таблица