Слайд 2Электролиз- это окислительно - восстановителный процесс, протекающий на электродах в растворах или

расплавах электролитов при про пускании электрического тока.
Слайд 3Закон электролиза
Первый закон электролиза Фарадея
Масса вещества, которое осядет на электроде при
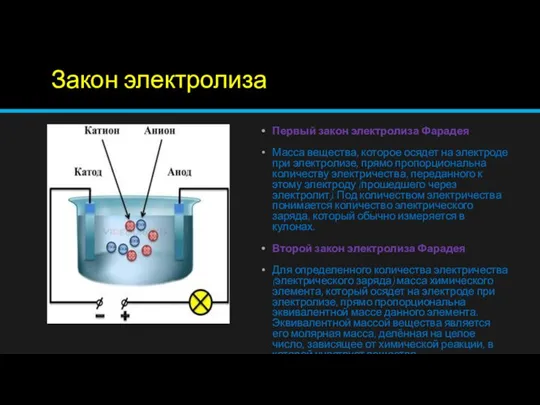
электролизе, прямо пропорциональна количеству электричества, переданного к этому электроду (прошедшего через электролит). Под количеством электричества понимается количество электрического заряда, который обычно измеряется в кулонах.
Второй закон электролиза Фарадея
Для определенного количества электричества (электрического заряда) масса химического элемента, который осядет на электроде при электролизе, прямо пропорциональна эквивалентной массе данного элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество
Слайд 4 Электролиз в расплавах
На катоде происходит процесс восстановления
Мn+ + nē

= М0
На аноде происходит процесс окисления В расплавах анионы бескислородных кислот (кроме фторидов) окисляются до соответствующего простого вещества, например: 2Cl– – 2ē = Cl20
Кислородсодержащие анионы выделяют кислород и превращаются в один из оксидов:
SO42– – 2ē = SO20 + O20.
Слайд 5Электролиз расплава NаCl
К(-) NaCl А(+)
↓
← Na+ + Cl- →
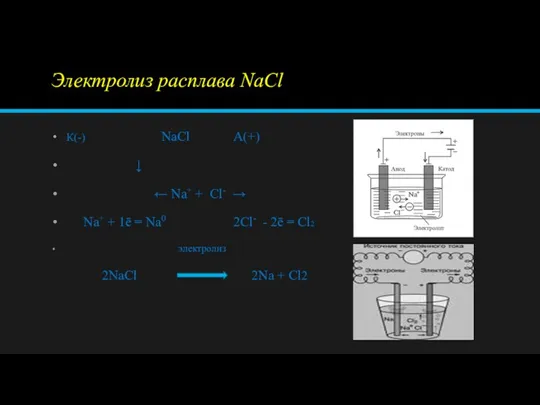
Na+ + 1ē = Na0 2Cl- - 2ē = Cl2
электролиз
2NaCl 2Na + Cl2
Слайд 6 Процесс на аноде
В растворах процесс на аноде зависит от материала анода

и от природы аниона. Аноды могут быть двух видов – растворимые (железо, медь, цинк, серебро и все металлы, которые окисляются в процессе электролиза) и нерастворимые, или инертные (уголь, графит, платина, золото)
а) Если анод растворимый, то независимо от природы аниона всегда идет окисление металла анода, например:
Cu0 – 2ē = Cu2+
б) Если анод инертный, то в случае бескислородных анионов (кроме фторидов) идет окисление анионов:
2Cl– – 2ē = Cl20
Слайд 7Электролитическое рафинирование (очистка) меди.
Неочищенная медь, которая является анодом, растворяется, т. е.

переходит в раствор соли меди в виде ионов. Энергия электрического тока расходуется на перенос этих ионов к катоду, их восстановление и осаждение чистой меди (степень чистоты – 99,95%). Примеси (Ag, Au и другие благородные металлы), которые имеют больший стандартный электродный потенциал, не окисляются, а выпадают в осадок на дне ванны, тем самым окупая расходы на проведение рафинирования меди. Данный процесс – одно их старейших электрохимических производств. Впервые этот метод был применен в России в 1847 г.
Слайд 8Изменение восстановительной активности анионов
Анионы по их способности окисляться располагаются в следующем порядке:

I-, Br-, S2-, Cl-, OH-, SO42-, NO3-, F-
Восстановительная активность уменьшается
Слайд 9Электролиз раствора поваренной соли

Слайд 10Применение электролиза
Электрометаллургия: а) получение активных металлов (K, Na, Ca, Mg, Al и

др.) электролизом расплавов природных соединений; б) получение металлов средней активности (Zn, Cd, Co) электролизом растворов их солей.
В химической промышленности – получение газов: F2, Cl2, H2, O2; щелочей: NaOH, KOH; пероксида водородаH2O2, тяжелой воды D2O и др.
Электролитическое рафинирование – очистка металлов (Cu, Pb, Sn и др.) от примесей электролизом с применением активных (растворимых) анодов.
Гальваностегия – нанесение металлических покрытий на поверхность металлического изделия для защиты от коррозии или придания декоративного вида. Например, оцинковка, хромирование, никелирование и пр.
Гальванопластика – получение металлических копий с различных матриц, а также покрытие неметаллических предметов слоем металлов. Последний процесс (золочение деревянных статуй и ваз) был известен еще в Древнем Египте, но научные основы гальванопластики были заложены русским ученым Б. Якоби в 1838 г.
Слайд 12 получение щелочей, хлора, водорода












 Основания. 8 класс
Основания. 8 класс Литий
Литий Теория химического строения органических веществ А.М. Бутлерова
Теория химического строения органических веществ А.М. Бутлерова Спирт и его влияние на организм человека
Спирт и его влияние на организм человека Фосфор, строение, свойства
Фосфор, строение, свойства Минералы. Определения, понятия
Минералы. Определения, понятия Свойства белков
Свойства белков Турнир знатоков химии
Турнир знатоков химии Коррозия металлов
Коррозия металлов Неорганическая и органическая химия
Неорганическая и органическая химия Ядро атома (тест)
Ядро атома (тест) Классификация аминокислот в зависимости от природы радикалов
Классификация аминокислот в зависимости от природы радикалов Смеси и взвеси веществ. Простейшие операции с веществом
Смеси и взвеси веществ. Простейшие операции с веществом 01_Khimicheskiy_sostav
01_Khimicheskiy_sostav 01. Химический состав
01. Химический состав Металлы
Металлы Химическое равновесие. Экзаменационные вопросы
Химическое равновесие. Экзаменационные вопросы Презентация на тему Дисперсные системы и растворы
Презентация на тему Дисперсные системы и растворы  Скорость химических реакций
Скорость химических реакций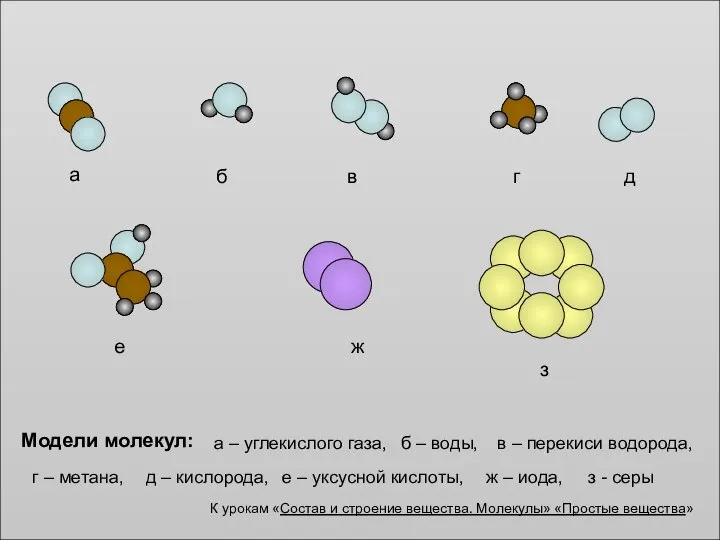 Модели молекул
Модели молекул Классификация органических соединений. Предельные углеводороды (УВ)
Классификация органических соединений. Предельные углеводороды (УВ) Великие ученые общей и неорганической химии
Великие ученые общей и неорганической химии Enantioselective Total Synthesis of (−)-Caldaphnidine O
Enantioselective Total Synthesis of (−)-Caldaphnidine O Введение в практическую деятельность
Введение в практическую деятельность Алкины
Алкины Методика исследования роста оксида кремния SiO2 c помощью РФЭС. Лекция 2
Методика исследования роста оксида кремния SiO2 c помощью РФЭС. Лекция 2 Изомерия
Изомерия Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений
Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений