Слайд 2 Едва ли найдётся другое, искусственно добываемое, вещество, столь часто применяемое в

технике, как серная кислота. Там, где техническая деятельность развита, там потребляется и много серной кислоты.
Д. И. Менделеев
Слайд 3Реакции разбавленной серной кислоты с активными металлами
2Li + H2 SO4 = Li2SO4

+ H2 ↑
Li 0 - 1 e → Li+ *2 восстановитель
2H + + 2e → H2 0 окислитель
Ca + H2 SO4 = CaSO4 + H2 ↑
Ca 0 - 2 e → Ca 2 восстановитель
2H + + 2e → H2 0 окислитель
Слайд 4Реакции разбавленной серной кислоты с металлами средней активности
Zn + H2SO4 =

ZnSO4 + H2 ↑
Zn0 - 2e → Zn 2+ восстановитель
2H+ + 2e → H2 окислитель
Слайд 5Реакции разбавленной серной кислоты с алюминием и железом
2Al + 3H2 SO4 =

Al2(SO4)3+3H2 ↑
Al0 – 3e →Al+3 *2 восстановитель
2H+ + 2e → H2 *3 окислитель
Fe+ H2SO4 = FeSO4 + H2↑
Fe0 -2e →Fe+2 *1 восстановитель
2H+ + 2e → H2 *1 окислитель
Слайд 6Реакции разбавленной серной кислоты с малоактивными металлами
Cu + H2SO4 - не взаимодействует

Слайд 7Реакции концентрированной серной кислоты с активными металлами
8Na + 5H2 SO4 (k) =

H2S + 4Na2SO4 + 4H2O
Na 0 - 1 e → Na+ *8 восстановитель
S+6 +8e →S-2 *1 окислитель
Слайд 8Реакции концентрированной серной кислоты с металлами средней активности
Zn + 2H2 SO4 =

ZnSO4 + 2H2O + SO2
Zn 0 - 2 e → Zn+ 2 восстановитель
S+6 + 2 e → S+4 окислитель
4Zn + 5H2 SO4 = 4ZnSO4 + 4H2O + H2S
Zn 0 - 2 e → Zn+ 2 *4 восстановитель
S+6 + 8 e → S-2 *1 окислитель
3Zn + 4H2 SO4 = 3ZnSO4 + 4 H2O + S
Zn 0 - 2 e → Zn+ 2 *3 восстановитель
S+6 + 6 e → S0 *1 окислитель
Слайд 9Реакции концентрированной серной кислоты с алюминием и железом
На холоде концентрированная серная кислота

пассивирует многие металлы, в том числе РЬ, Cr, Ni, сталь, чугун.При нагревании реакционной смеси происходит химическая реакция:
8Al+15 H2SO4 =4 Al2(SO4)3+3H2S↑ +12H2O
Al0 – 3e →Al+3 *8 восстановитель
S+6 +8e →S-2 *3 окислитель
8Fe+15 H2 SO4 =4 Fe2(SO4)3+3H2 S↑ +12H2O
Fe0 – 3e →Fe+3 *8 восстановитель
S+6 +8e →S-2 *3 окислитель
Слайд 10Реакции концентрированной серной кислоты с малоактивными металлами
Cu + 2H2 SO4 = CuSO4

+ 2H2O + SO2
Cu 0 - 2 e → Cu+ 2 восстановитель
S+6 + 2 e → S+4 окислитель
Слайд 11Реакции концентрированной серной кислоты с неметаллами
S + 2H2 SO4 = 2H2O +

3SO2
S 0 - 4 e → S+4 восстановитель
S +6 + 2 e → S+4 *2 окислитель
2P + 5H2 SO4 = 2H3PO4 + 5SO2 + 2H2O
P 0 - 5 e → P 5+ *2 восстановитель
S 6+ +2e → S+4 *5 окислитель
Слайд 12Взаимодействие концентрированной серной кислоты с органическими веществами
С12Н22О11 + H2 SO4 =
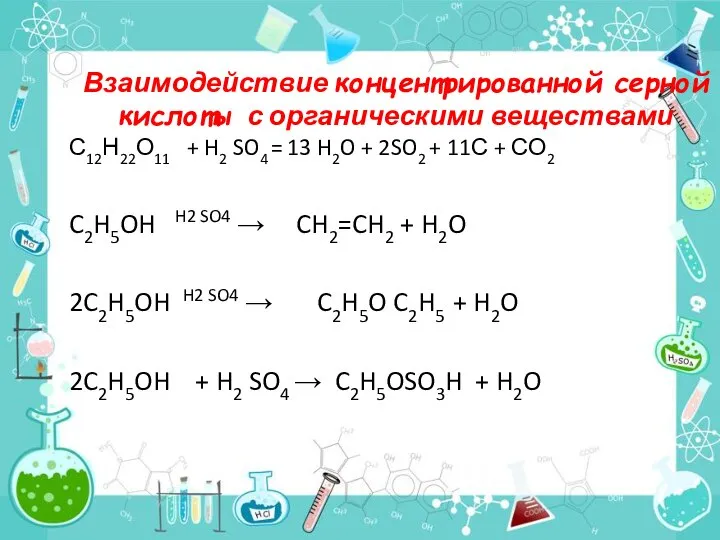
13 H2O + 2SO2 + 11С + СО2
C2H5OH H2 SO4 → CH2=CH2 + H2O
2C2H5OH H2 SO4 → C2H5O C2H5 + H2O
2C2H5OH + H2 SO4 → C2H5OSO3H + H2O











 Алмашу реакциясе
Алмашу реакциясе Химические реактивы
Химические реактивы Химическое сопротивление материалов
Химическое сопротивление материалов Строение, свойства и функции аминокислот и белков
Строение, свойства и функции аминокислот и белков Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение
Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение Основы стереохимии
Основы стереохимии Амфотерность оксида и гидроксида алюминия
Амфотерность оксида и гидроксида алюминия Алифатические и ароматические амины
Алифатические и ароматические амины Антитела. Что такое антитела?
Антитела. Что такое антитела? Решение задач Расчет количества протонов, нейтронов, электронов в атомах различных химических элементов.
Решение задач Расчет количества протонов, нейтронов, электронов в атомах различных химических элементов. Презентация на тему Подгруппа углерода
Презентация на тему Подгруппа углерода  Конденсированные гетероциклы. Нуклеотиды. Нуклеиновые кислоты
Конденсированные гетероциклы. Нуклеотиды. Нуклеиновые кислоты Степень окисления
Степень окисления Михаил Васильевич Ломоносов (1711-1765)
Михаил Васильевич Ломоносов (1711-1765) Презентация на тему Элементы главной подгруппы V группы
Презентация на тему Элементы главной подгруппы V группы  Производство метанола
Производство метанола Алкены. Решение задач и упражнений
Алкены. Решение задач и упражнений Chemsheets AS 1009 (Electron arrangement)
Chemsheets AS 1009 (Electron arrangement) Самородные элементы. Сера. Лекция 7
Самородные элементы. Сера. Лекция 7 صيغ المركبات وأسمائها
صيغ المركبات وأسمائها Природные источники углеводородов
Природные источники углеводородов Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений
Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений Строение сплавов, диаграммы состояний
Строение сплавов, диаграммы состояний Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства
Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства Минералы. Определения, понятия
Минералы. Определения, понятия Закон эквивалентов
Закон эквивалентов Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация