Содержание
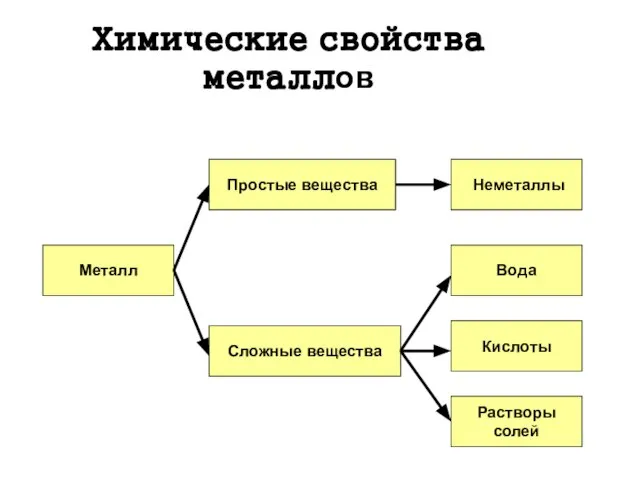
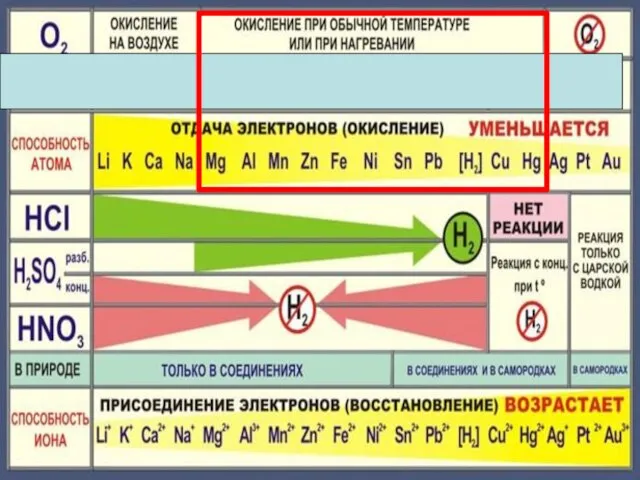
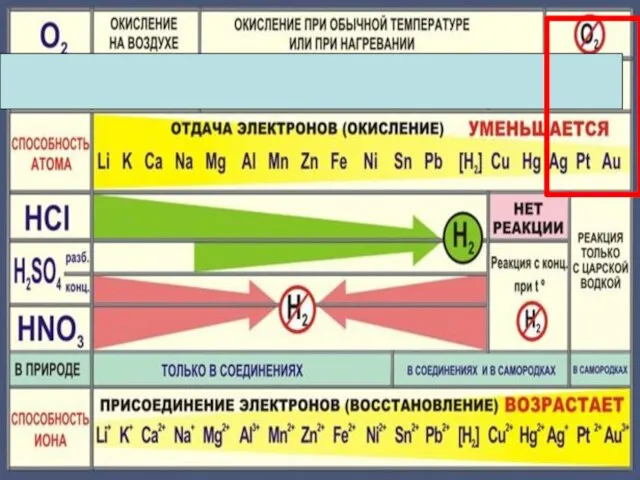
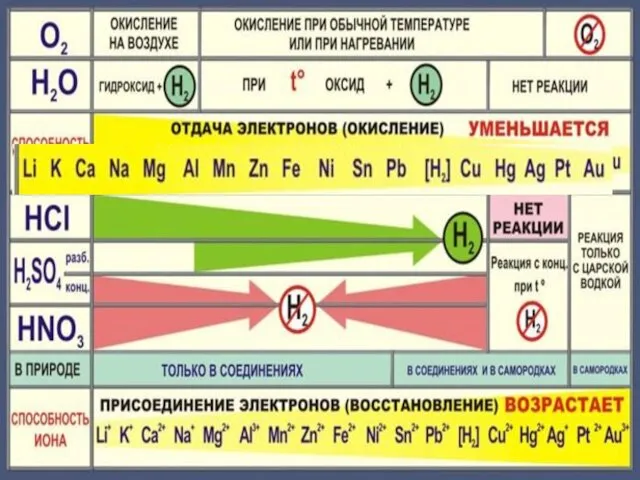
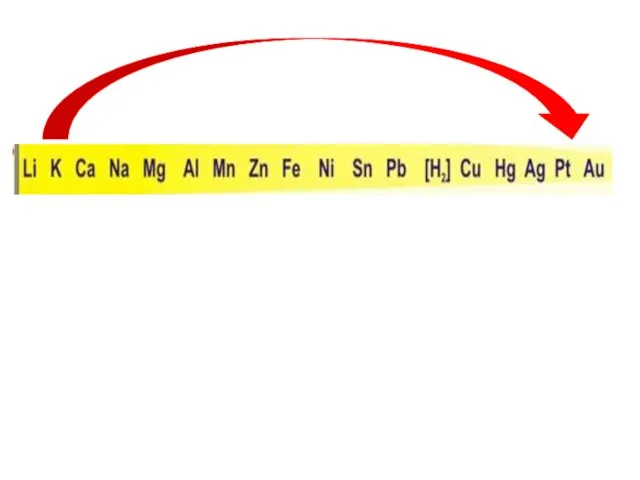
- 5. Химические свойства металлов Металл Простые вещества Сложные вещества Неметаллы Вода Кислоты Растворы солей
- 6. Cu + Cl2 =CuCl2 2Mg + CO2 = 2MgO + C С неметаллами С кислотными оксидами
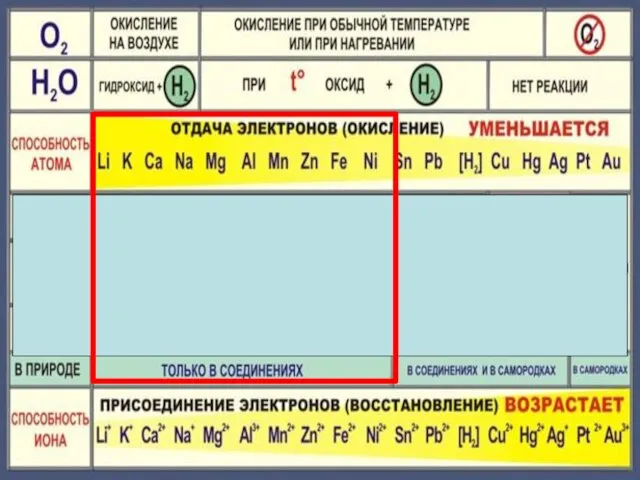
- 10. 4Na + O2 = 2Na2O 2Mg + O2 = 2MgO при нагревании 4Ag + O2 =
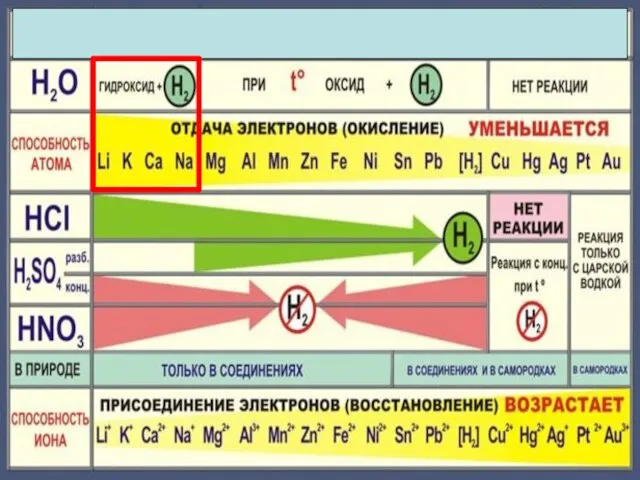
- 12. 2Na + 2H2O ? 2NaOH +H2 2K + 2H2O = 2KOH + H2
- 14. 3Fe + 4H2O = Fe3O4+4 H2
- 16. Cu + H2О = реакция не идет
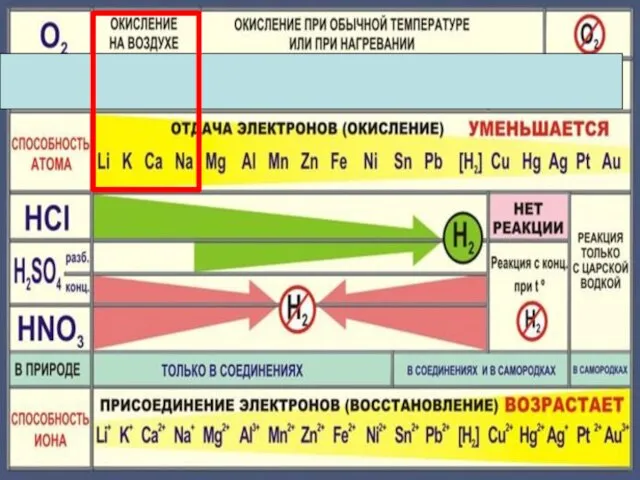
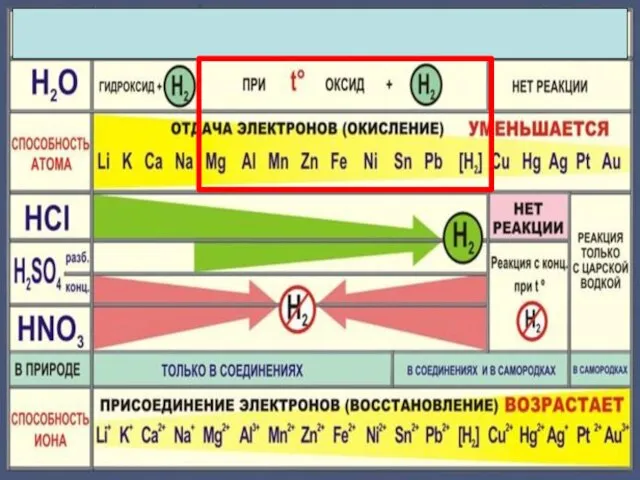
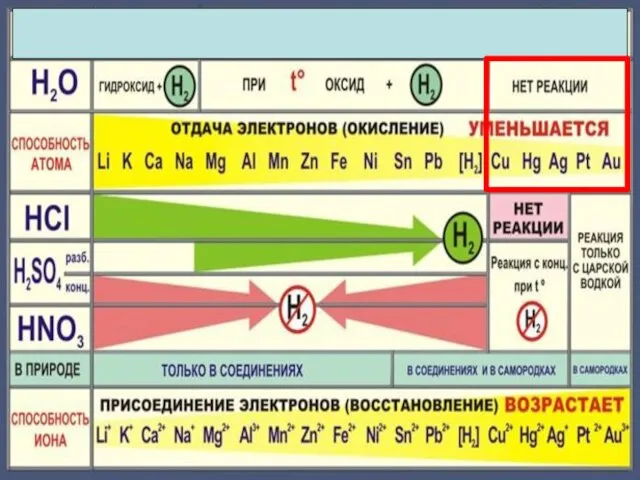
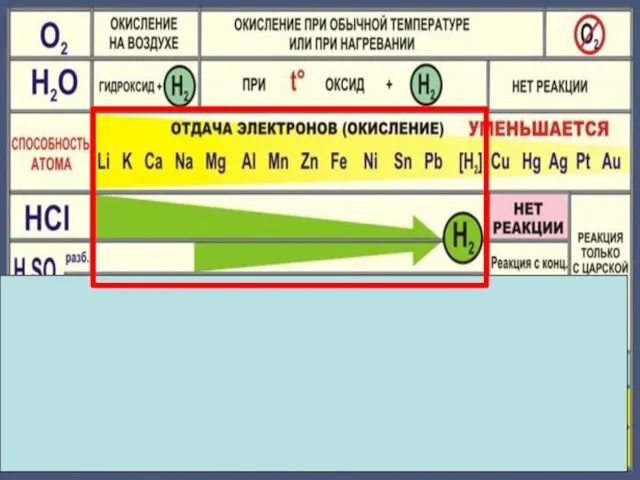
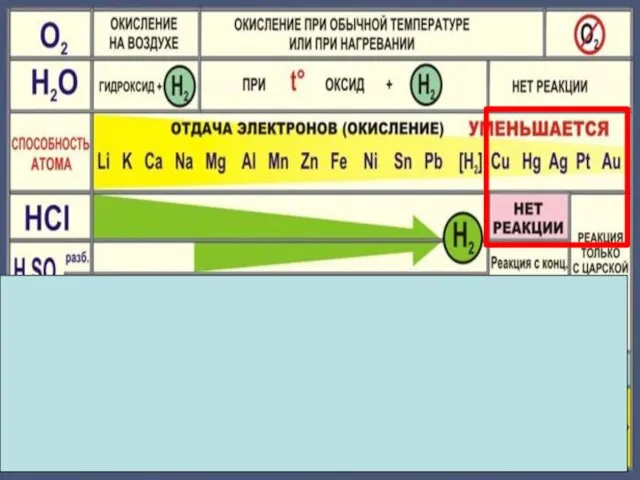
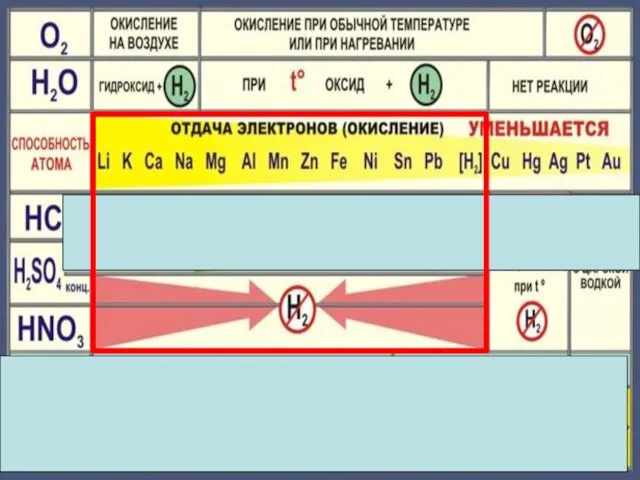
- 18. Zn + 2HCl = ZnCl2 + H2 Fe + 2HCl = FeCl2 + H2 Cu +
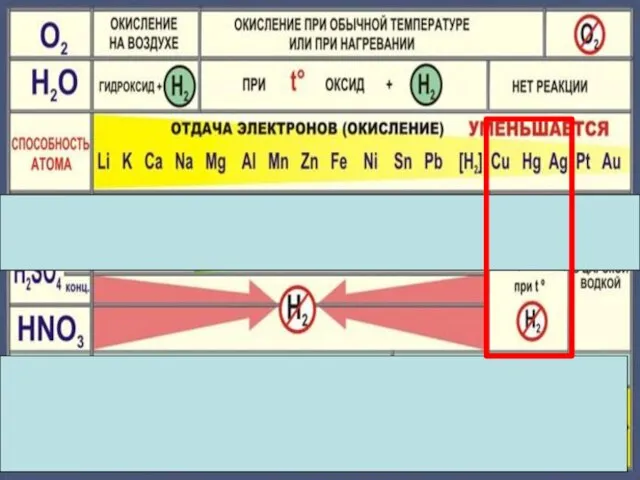
- 22. Cu + 2H2 SO4конц. = Cu SO4 +SO2 +2H2 O Cu + 4HNO3 конц. = Cu(NO3)2
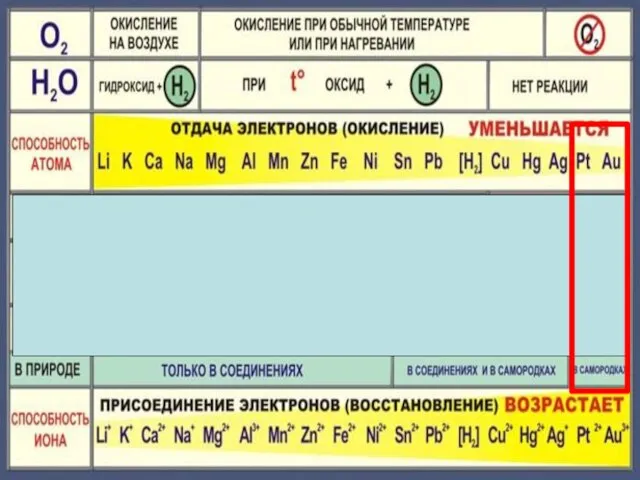
- 23. Состав «царской водки»: смесь концентрированных азотной HNO3 (65-68 % масс.) и соляной HCl (32-35 % масс.)
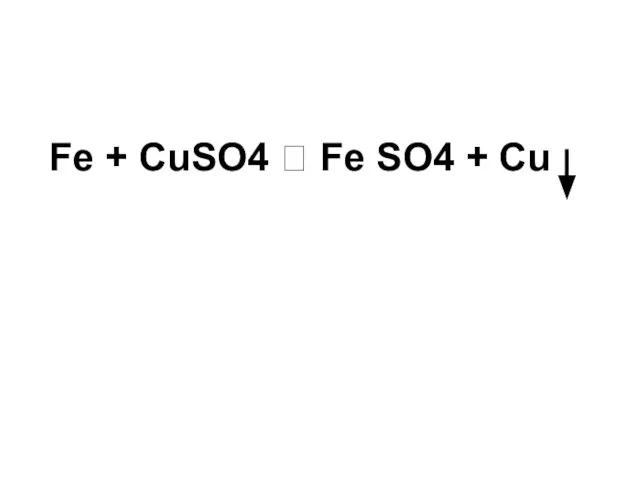
- 26. Fe + CuSO4 ? Fe SO4 + Cu
- 28. Скачать презентацию



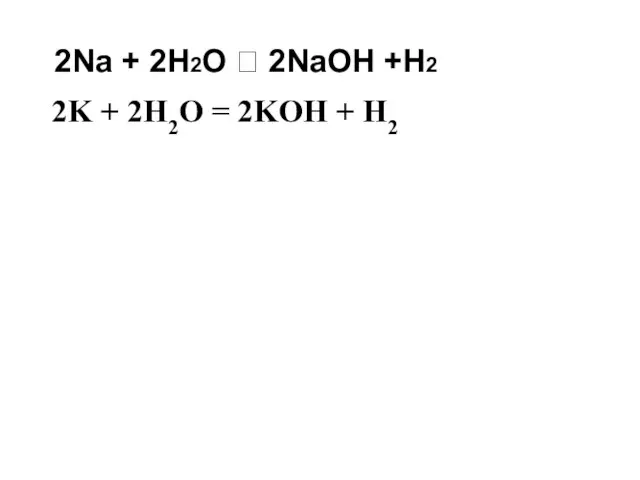


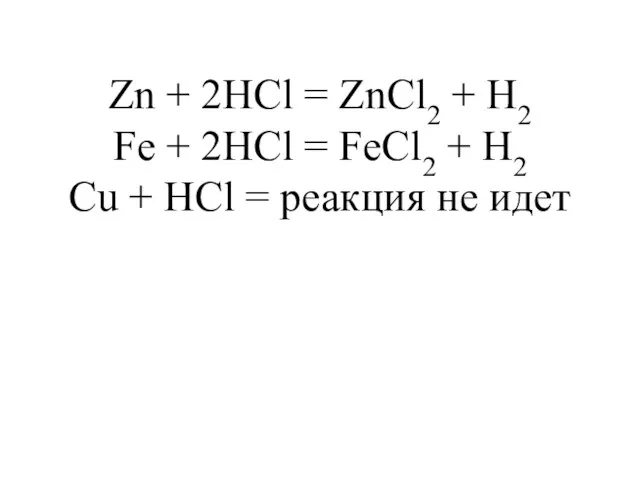
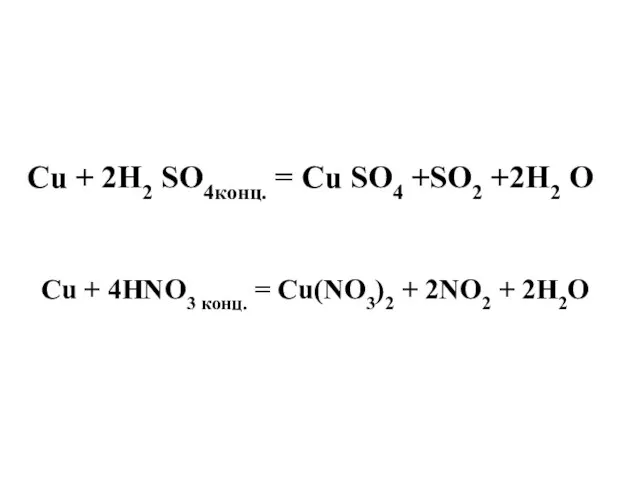

 Патриотическое воспитание школьников на уроках
Патриотическое воспитание школьников на уроках Дисперсные системы
Дисперсные системы Степени окисления и формулы веществ
Степени окисления и формулы веществ Фосфор и его соединения
Фосфор и его соединения Растворы
Растворы Основные понятия физической химии
Основные понятия физической химии Реакции этерификации
Реакции этерификации Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Презентация на тему Элементы таблицы Менделеева
Презентация на тему Элементы таблицы Менделеева  Мутагены окружающей среды
Мутагены окружающей среды Схема монооксигеназной цепи микросом
Схема монооксигеназной цепи микросом Неорганический мозговой штурм
Неорганический мозговой штурм Фракционный состав нефти. Химический состав нефти
Фракционный состав нефти. Химический состав нефти Три агрегатных состояния веществ
Три агрегатных состояния веществ Формирование полимерной структуры при отверждении олигомеров. Каучуки и резины
Формирование полимерной структуры при отверждении олигомеров. Каучуки и резины Химические реакции
Химические реакции Презентация на тему Окислительно-восстановительные реакции
Презентация на тему Окислительно-восстановительные реакции  Обобщение и систематизация знаний по теме Вещества и их классификация
Обобщение и систематизация знаний по теме Вещества и их классификация Рубидий (Rb). Цезий (Cs). Франций (Fr)
Рубидий (Rb). Цезий (Cs). Франций (Fr) Введение в биохимию. Строение и свойства белков
Введение в биохимию. Строение и свойства белков О некоторых удивительных удивительных свойствах свойствах веществ
О некоторых удивительных удивительных свойствах свойствах веществ Щелочноземельные металлы
Щелочноземельные металлы Карбид кальция. Назначение
Карбид кальция. Назначение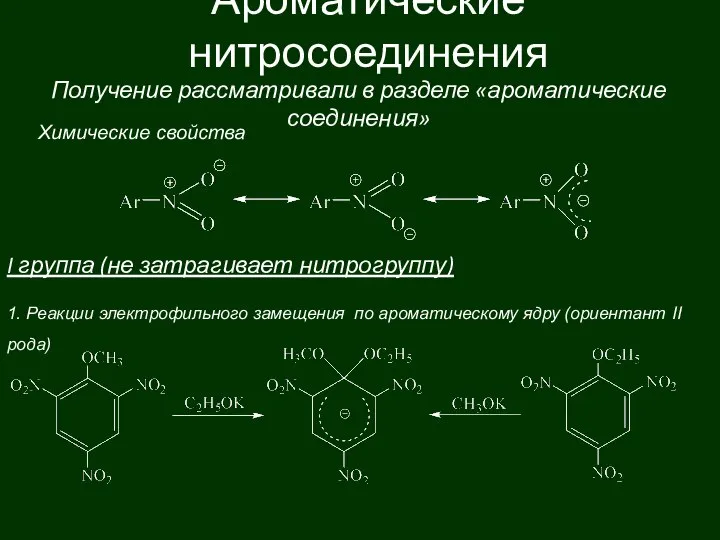 Ароматические нитросоединения
Ароматические нитросоединения Моносахариды
Моносахариды Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Азотсодержащие. Амины (семинар)
Азотсодержащие. Амины (семинар) Химическая промышленность России входит в авангардную тройку
Химическая промышленность России входит в авангардную тройку