алюмосиликатов различных горных пород (граниты, гнейсы и т. п.), особенно в полевом шпате — анортите Ca[Al2Si2O8].
В виде осадочных пород соединения кальция представлены мелом и известняками, состоящими в основном из минерала кальцита (CaCO3). Кристаллическая форма кальцита — мрамор — встречается в природе гораздо реже.
Довольно широко распространены такие минералы кальция, как кальцит CaCO3, ангидрит CaSO4, алебастр CaSO4·0.5H2O и гипс CaSO4·2H2O, флюорит CaF2, апатиты Ca5(PO4)3(F,Cl,OH), доломит MgCO3·CaCO3. Присутствием солей кальция и магния в природной воде определяется её жёсткость.
Кальций, энергично мигрирующий в земной коре и накапливающийся в различных геохимических системах, образует 385 минералов (четвёртое место по числу минералов).
кальцит
Изделия из гранита










 Строение атома
Строение атома Генетичні зв’язки між неорганічними речовинами
Генетичні зв’язки між неорганічними речовинами Химический состав живых организмов. Метаболизм
Химический состав живых организмов. Метаболизм Комплексные соединения
Комплексные соединения Вклад Д.И. Менделеева в науку
Вклад Д.И. Менделеева в науку Презентация на тему Актуальные проблемы газовой отрасли России
Презентация на тему Актуальные проблемы газовой отрасли России  G12 - класс антифризов
G12 - класс антифризов Электрохимическая коррозия
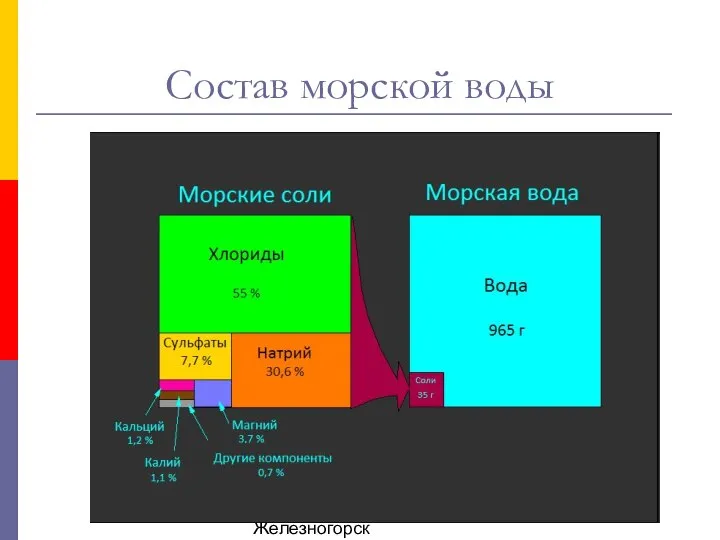
Электрохимическая коррозия Свойства солёной воды. Море у меня в стакане
Свойства солёной воды. Море у меня в стакане Кислород
Кислород Цинк и его применение (11 класс)
Цинк и его применение (11 класс) Железо и его сплавы
Железо и его сплавы АЛКЕНЫ-10
АЛКЕНЫ-10 Строение атома. История открытия атома
Строение атома. История открытия атома Газообразные вещества и их применение
Газообразные вещества и их применение Природный газ, состав применение в качестве топлива
Природный газ, состав применение в качестве топлива Химические реакции. Классификация
Химические реакции. Классификация Получение металлов
Получение металлов Презентация на тему Химия в косметике
Презентация на тему Химия в косметике  Влияние меди на коррозию низколегиованных сталей
Влияние меди на коррозию низколегиованных сталей 3_Kislorodsoderzhaschie_kisloty_khlora
3_Kislorodsoderzhaschie_kisloty_khlora Тефлон
Тефлон Стекло. История открытия. Самое древнее производство Эпохи фараонов
Стекло. История открытия. Самое древнее производство Эпохи фараонов Растворение. Экспериментальная работа с веществами
Растворение. Экспериментальная работа с веществами Аналитические методы в современных исследованиях химии
Аналитические методы в современных исследованиях химии Электропроводность растворов и электрохимия
Электропроводность растворов и электрохимия Металлы и неметаллы
Металлы и неметаллы Периодическая система
Периодическая система