Содержание
- 2. Для разбавленных растворов (1 – α) = 1 закон разбавления Оствальда Слабые электролиты Для бинарного электролита:
- 3. Теория Дебая-Хюккеля: Ионы рассматриваются как точечные заряды, при этом расстояния между ионами бесконечно велики по сравнению
- 4. Электропроводность растворов электролитов Удельная электропроводность (ᴂ) – это величина обратно пропорциональная удельному сопротивлению (ρ). Удельная электропроводность
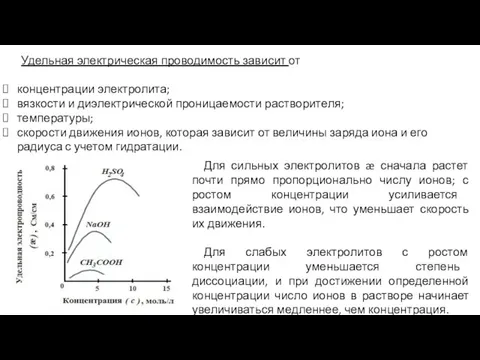
- 5. Удельная электрическая проводимость зависит от концентрации электролита; вязкости и диэлектрической проницаемости растворителя; температуры; скорости движения ионов,
- 6. Электропроводность электролитов Эквивалентная электропроводность (λ) – это электропроводность раствора, содержащего 1 моль-экв электролита, находящегося между двумя
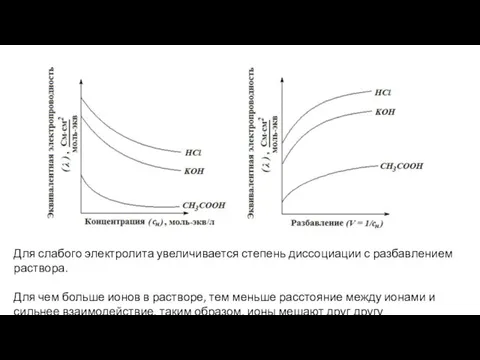
- 7. Для слабого электролита увеличивается степень диссоциации с разбавлением раствора. Для чем больше ионов в растворе, тем
- 8. Закон Кольрауша: молярная эквивалентная электропроводность при бесконечном разбавлении равна сумме электролитических подвижностей катиона и аниона данного
- 9. Электрохимические процессы Ох + ze– ⇔ Red
- 10. Электрохимические элементы. Электродвижущая сила Гальванический элемент – устройство для получения электрического тока за счет электрохимических реакций.
- 11. ЭДС гальванического элемента ε – потенциал электрода, ε0 – стандартный потенциал электрода, R – универсальная газовая
- 12. ЭДС и свободная энергия Гиббса ΔG0 = –nF⋅Е 2KMnO4 + 16HCl = 2MnCl2 + 8H2O +
- 13. Направление ОВР ОВР может быть проведена либо электрохимически, либо в пробирке . Полуреакции будут идентичны, поэтому
- 14. Классификация электродов Электроды первого рода состоят из металлической пластинки, погруженной в раствор соли того же металла.
- 15. Окислительно-восстановительные электроды представляют собой пластину из инертного металла, погруженную в раствор, содержащий окисленные и восстановленные формы
- 16. Потенциометрический метод анализа Основан на измерении разности потенциалов (электродвижущей силы - ЭДС) между двумя электродами, погруженными
- 17. Водородный электрод: платиновая пластинка, омываемая газообразным водородом, погруженная в раствор, содержащий ионы водорода. Адсорбируемый платиной водород
- 18. Индикаторный электрод – это электрод, на котором происходит электрохимическая реакция окисления или восстановления, в ходе которой,
- 20. Скачать презентацию















 Открытый урок по химии в 8 классе по теме: «Первоначальные химические понятия». Учитель химии ГБОУ СОШ № 650 Безверхова Олеся Влад
Открытый урок по химии в 8 классе по теме: «Первоначальные химические понятия». Учитель химии ГБОУ СОШ № 650 Безверхова Олеся Влад Презентация на тему Викторина "Узнай химический элемент"
Презентация на тему Викторина "Узнай химический элемент"  Агрегатные состояния вещества
Агрегатные состояния вещества Презентация на тему Щелочноземельные металлы
Презентация на тему Щелочноземельные металлы  Химическая промышленность. Аварии на химических предприятиях
Химическая промышленность. Аварии на химических предприятиях Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Выращивание кристаллов
Выращивание кристаллов Валентность. Валентные возможности атомов
Валентность. Валентные возможности атомов Строение вещества. Химическая связь
Строение вещества. Химическая связь Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего Химическая кинетика. Факторы, влияющие на скорость реакции
Химическая кинетика. Факторы, влияющие на скорость реакции Свойства неорганических веществ
Свойства неорганических веществ Кипение. Испарение
Кипение. Испарение Сложные эфиры. Содержание. Определение
Сложные эфиры. Содержание. Определение Новое в ЕГЭ. Химия
Новое в ЕГЭ. Химия Условия среды, вызывающие коррозию металла
Условия среды, вызывающие коррозию металла Расчет константы равновестия для реакции
Расчет константы равновестия для реакции Изготовление индикаторной бумаги
Изготовление индикаторной бумаги Адамсит. Дигидрофенарсазинхлорид HN(C6H4)2AsCl
Адамсит. Дигидрофенарсазинхлорид HN(C6H4)2AsCl Ліпіди
Ліпіди Натуральный каучук
Натуральный каучук Область применения карбоновых кислот
Область применения карбоновых кислот Химия и автомобиль
Химия и автомобиль СТРОЕНИЕ АТОМА ПРОТОНЫ ЭЛЕКТРОНЫ НЕЙТРОНЫ
СТРОЕНИЕ АТОМА ПРОТОНЫ ЭЛЕКТРОНЫ НЕЙТРОНЫ Липиды
Липиды Природные источники углеводородов
Природные источники углеводородов Органическая химия. Химические свойства и типы реакций. (9 класс)
Органическая химия. Химические свойства и типы реакций. (9 класс) Коррозия металлов
Коррозия металлов