Слайд 2История названия
Аммиак (в европейских языках его название звучит как «аммониак») своим названием

обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак.
По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
Слайд 3Состав молекулы
NH3 или H3N
-3
-3

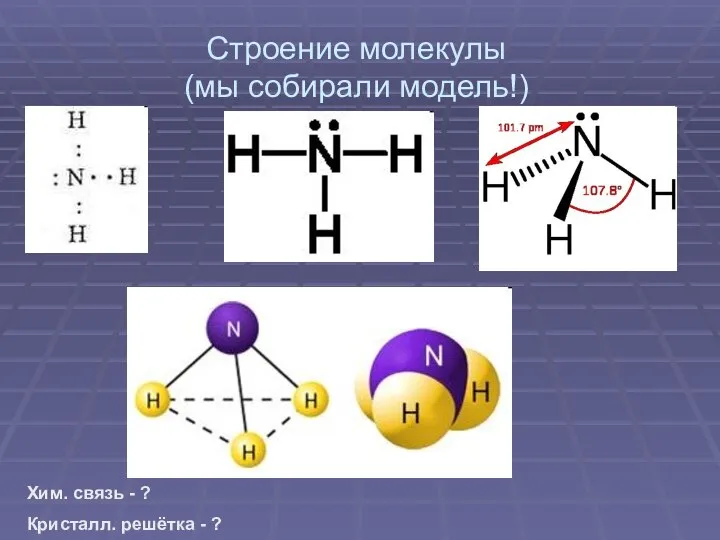
Слайд 4Строение молекулы
(мы собирали модель!)
Хим. связь - ?
Кристалл. решётка - ?
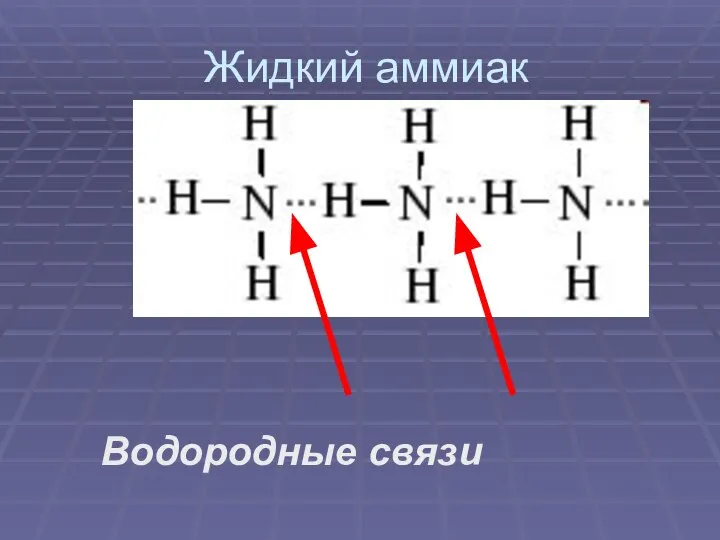
Слайд 5Жидкий аммиак
Водородные связи
Слайд 6Физические свойства (при н.у. )
бесцветный газ
с резким характерным запахом (запах

нашатырного спирта)
легче воздуха
хорошо растворяется в воде (1200 объёмов (при 0 °C) и 700 объёмов (при 20 °C) в объёме воды
Температура плавления -77.73 °C
Температура кипения -33.34 °C
Токсичен!
Слайд 7Токсикология
Относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении

вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи.
При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени.
Запах аммиака ощущается при концентрации 37 мг/м³.
ПДК (предельно допустимая концентрация) в воздухе рабочей зоны производственного помещения составляет 20 мг/м³. Следовательно, если чувствуется запах аммиака, то работать без средств защиты уже опасно.
ПДК в атмосферном воздухе населённых пунктов равна: среднесуточная 0,04 мг/м³; максимальная разовая 0,2 мг/м³.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Южно-Казахстанской области.
Слайд 8Биологическая роль
Аммиак является конечным продуктом азотистого обмена в организме человека и животных.

Большая часть аммиака преобразуется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.
Химические свойства.
1.Взаимодействие с водой:
NH3 + H2O↔NH4 + OH ↔ NH3· H2O
ион аммония Гидрат аммиака
2. Взаимодействие с кислотами.
Слайд 93. Восстановительные свойства
4NH3+ 3O2= 2N2+ 6H2O

Слайд 10Получение в лаборатории
NH4Cl + NaOH = NH3↑ + NaCl + H2O
NH4NO3 +
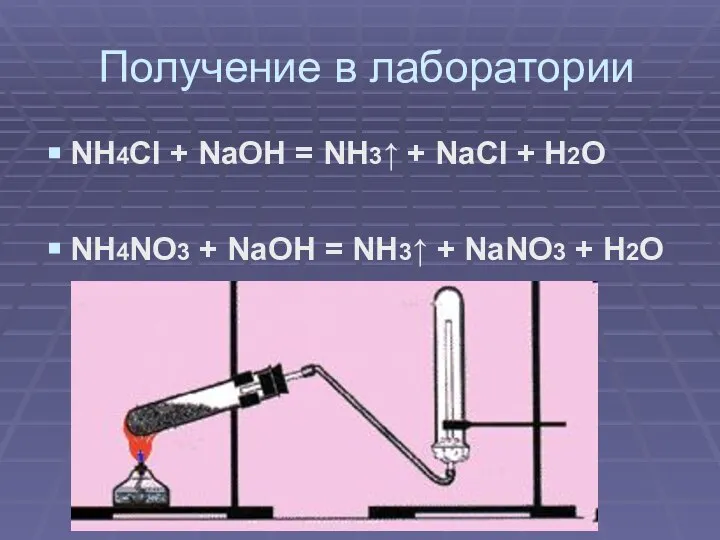
NaOH = NH3↑ + NaNO3 + H2O
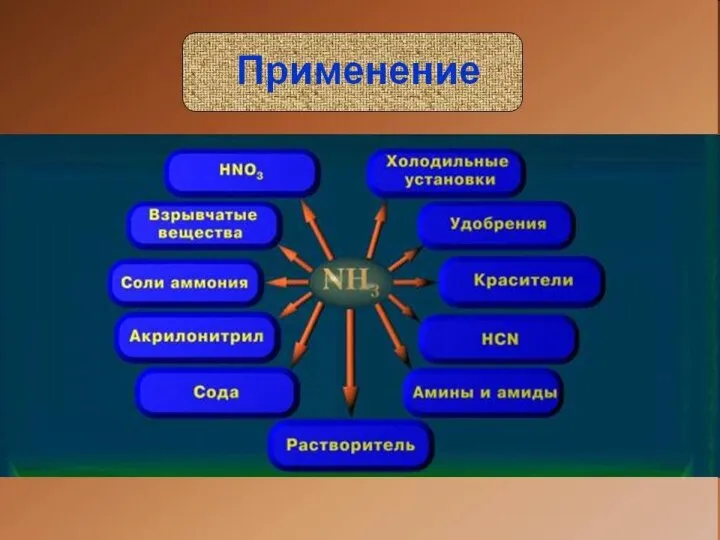
Слайд 12Интересные факты
Пары нашатырного спирта способны изменять окраску цветов. Например, голубые и синие

лепестки становятся зелеными, ярко красные — черными.
Облака Юпитера состоят из аммиака.
Некоторые цветы, не имеющие запаха от природы, после обработки аммиаком начинают благоухать. Например, приятный аромат приобретают астры.
Раствор аммиака (нашатырный спирт) применяют как средство первой помощи при обморочных состояниях: дают пациенту понюхать ватку , смоченную раствором.
Аммиак используют при отбеливании тканей и выведении пятен с поверхностей.
Аммиак входит в состав многих удобрений для растений.










 Ð¥ÐÐÐЧÐСÐÐÐ Ð ÐÐÐÐÐÐСÐÐ1
Ð¥ÐÐÐЧÐСÐÐÐ Ð ÐÐÐÐÐÐСÐÐ1 Budowa pasmowa ciał stałych
Budowa pasmowa ciał stałych 20141013_dragotsennye_kamni_yuzhnogo_urala
20141013_dragotsennye_kamni_yuzhnogo_urala Интересное о кристаллизации
Интересное о кристаллизации Арены. Бензол
Арены. Бензол Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Химическая связь и строение молекул
Химическая связь и строение молекул Типы химических реакций
Типы химических реакций Кристаллография
Кристаллография Презентация на тему Волокна
Презентация на тему Волокна  Медиатехнологии на уроках химии
Медиатехнологии на уроках химии Элементы принадлежащие к VII группе периодической таблицы - галогены
Элементы принадлежащие к VII группе периодической таблицы - галогены Относительная атомная масса. Массы атомов
Относительная атомная масса. Массы атомов Халькогены. Электронное строение кислорода и серы
Халькогены. Электронное строение кислорода и серы Азот
Азот Цветные реакции белков
Цветные реакции белков Полимеры
Полимеры Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры)
Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры) Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений
Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений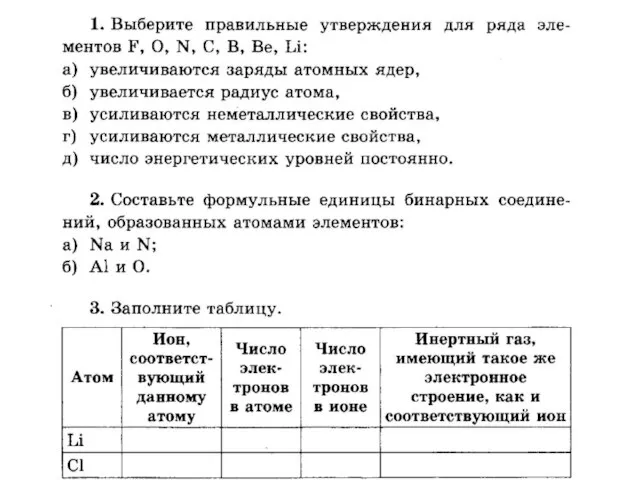 Взаимодействие атомов элементов-неметаллов между собой
Взаимодействие атомов элементов-неметаллов между собой Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Презентация на тему Спирты
Презентация на тему Спирты  Основы радиохимии и радиологии
Основы радиохимии и радиологии Ионные уравнения
Ионные уравнения Исследование биодеградации полимерных материалов методом АСМ
Исследование биодеградации полимерных материалов методом АСМ Как определять минералы
Как определять минералы Салициловая кислота
Салициловая кислота Амины, азо- и диазосоединения (продолжение)
Амины, азо- и диазосоединения (продолжение)