Содержание
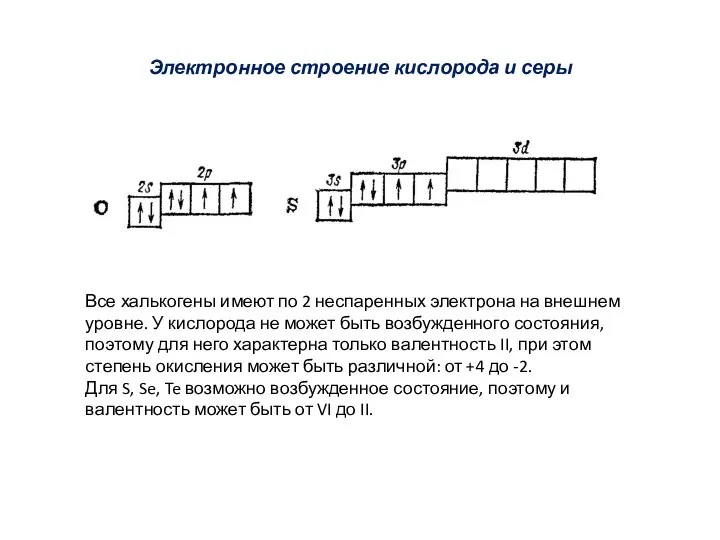
- 2. Электронное строение кислорода и серы Все халькогены имеют по 2 неспаренных электрона на внешнем уровне. У
- 3. Озон – аллотропная модификация кислорода. Получение и химические свойства озона Озон имеет один атом кислорода в
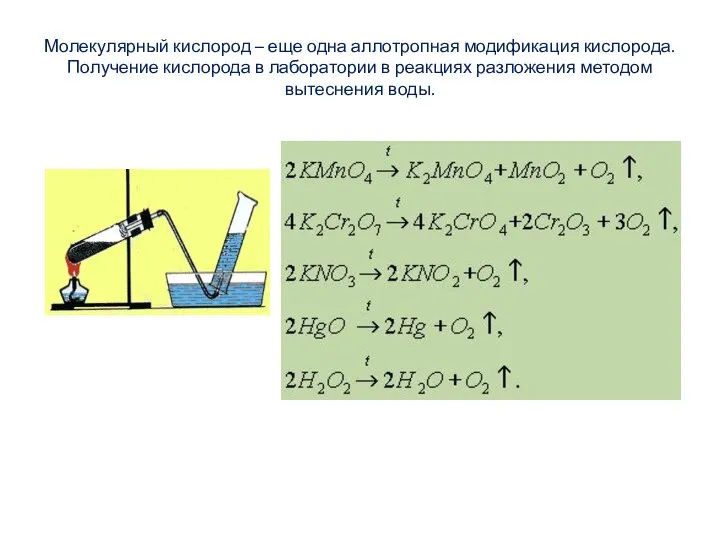
- 4. Молекулярный кислород – еще одна аллотропная модификация кислорода. Получение кислорода в лаборатории в реакциях разложения методом
- 10. Химические свойства сероводорода Получение из сульфидов Свойства электролита Свойства восстановителя полное сгорание неполное сгорание
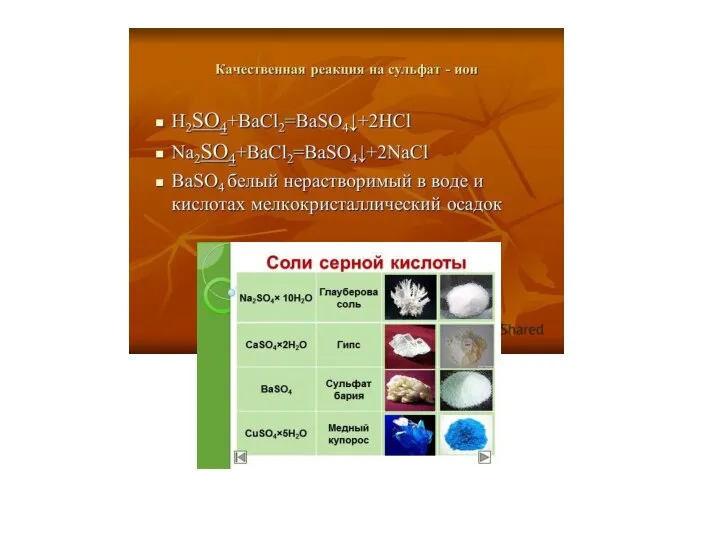
- 11. Качественные реакции на сульфид-ион: Большинство сульфидов нерастворимо и окрашены в черный цвет, за исключением сульфида ртути
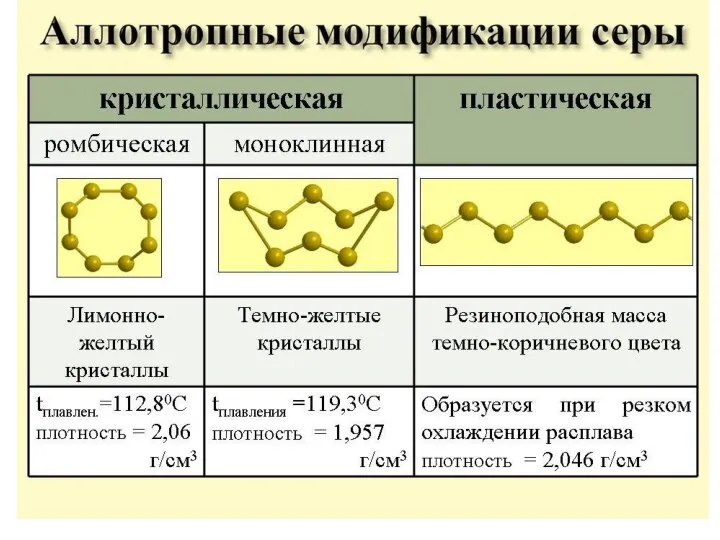
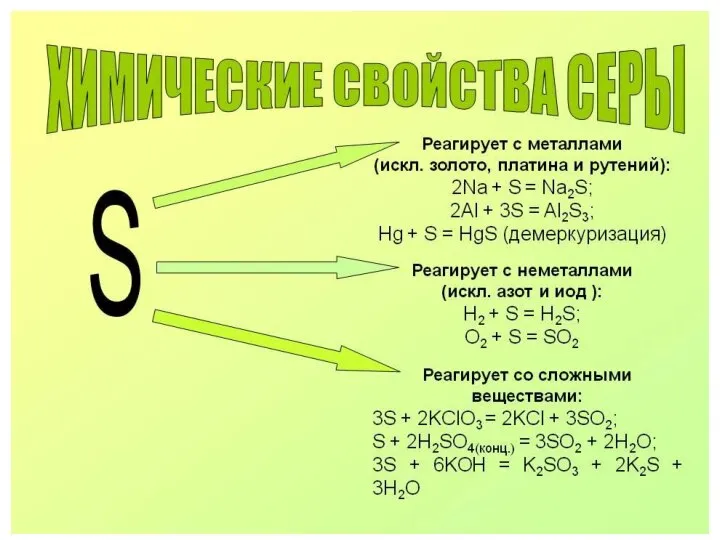
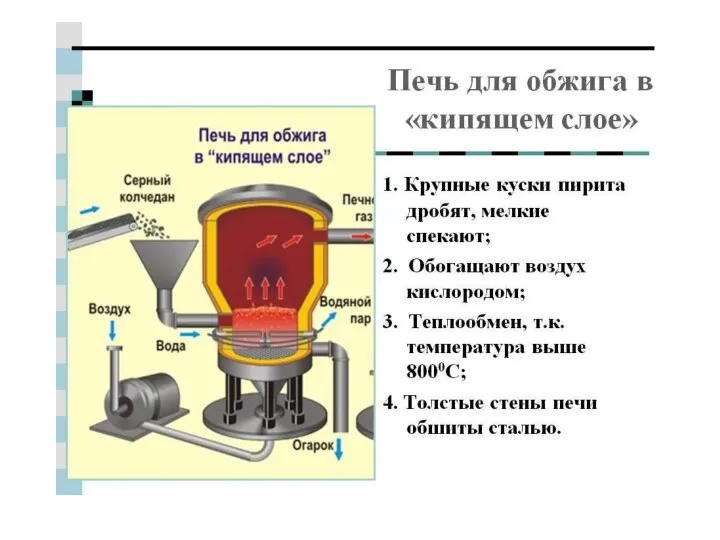
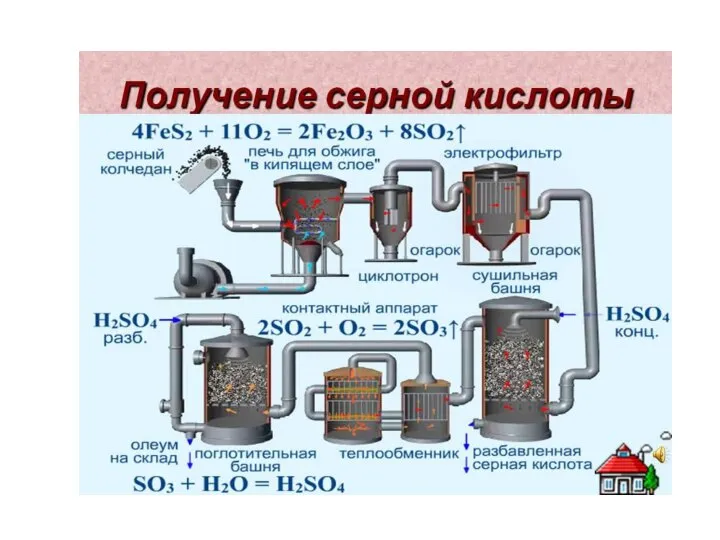
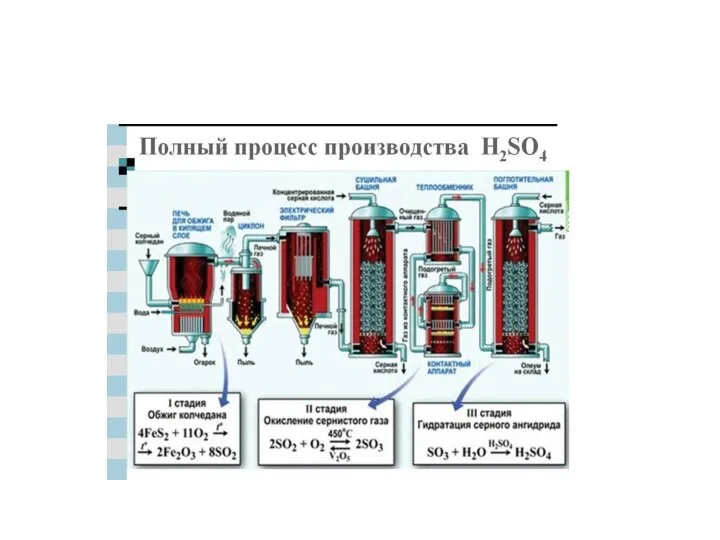
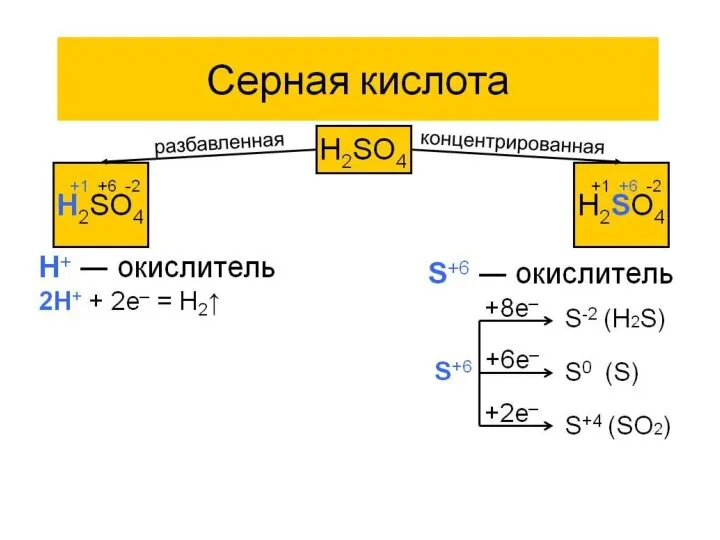
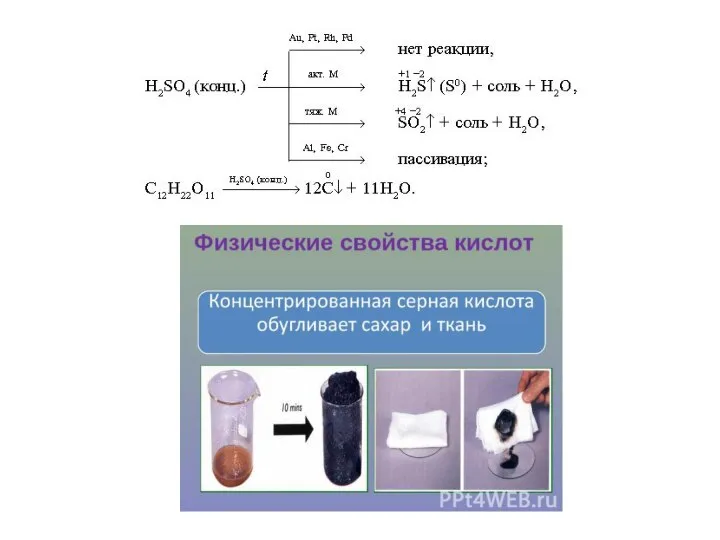
- 12. Сера +4: сернистый ангидрид , сернистая кислота, сульфиты.
- 21. Скачать презентацию








 Классификация химических реакций. 11 класс
Классификация химических реакций. 11 класс Электроотрицательность
Электроотрицательность Соли. Свойства. Получение
Соли. Свойства. Получение Путешествие в мир кислот
Путешествие в мир кислот Стерилизация технологических потоков и оборудования
Стерилизация технологических потоков и оборудования Углеродные материалы. Основные понятия и определения. Области их применения
Углеродные материалы. Основные понятия и определения. Области их применения Техника безопасности на уроках химии
Техника безопасности на уроках химии Презентация на тему М.В. Ломоносов
Презентация на тему М.В. Ломоносов  Основи молекулярно-кінетичної теорії
Основи молекулярно-кінетичної теорії Материаловедение и технология конструкционных материалов
Материаловедение и технология конструкционных материалов Химия в загадках
Химия в загадках Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Алмаз (С)
Алмаз (С) Окислительно – восстановительные реакции (урок химии в 11 классе)
Окислительно – восстановительные реакции (урок химии в 11 классе) Предельные углеводороды
Предельные углеводороды Производство полимеров в РК
Производство полимеров в РК Закон эквивалентов
Закон эквивалентов Теория строения химических соединений
Теория строения химических соединений Амины. Номенклатура аминов
Амины. Номенклатура аминов Язык естествознания. Химия
Язык естествознания. Химия Презентация на тему Химия и пища
Презентация на тему Химия и пища  01_Khimicheskiy_sostav
01_Khimicheskiy_sostav Процесс диссоциации
Процесс диссоциации Уравнение состояния идеального газа. Газовые законы. Изопроцессы
Уравнение состояния идеального газа. Газовые законы. Изопроцессы Общая характеристика галогенов на основе положения химических элементов в периодической системе
Общая характеристика галогенов на основе положения химических элементов в периодической системе Заполни электронные уровни элементов
Заполни электронные уровни элементов Презентация на тему Строение и свойства циклоалканов
Презентация на тему Строение и свойства циклоалканов  Физичекие явления - основа разделения смесей в химии. 17.09.21
Физичекие явления - основа разделения смесей в химии. 17.09.21