Содержание
- 2. Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде
- 3. Её величество Азотная кислота Яконюк Вера Сергеевна учитель химии МОУ Знаменская СОШ Урок химии 9класс
- 4. СОДЕРЖАНИЕ: Историческая справка Строение Получение.Лабороторный способ Промышленный способ Физические свойства Химические свойства.Общие с другими кислотами Химические
- 5. Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса: 4KNO3 + 2(FeSO4 · 7H2O)
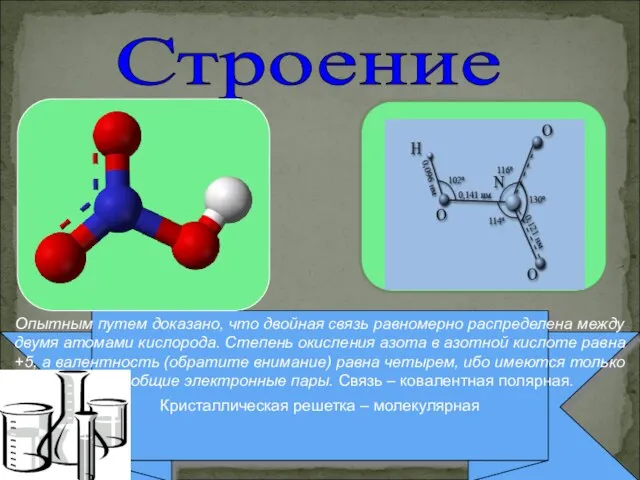
- 6. Опытным путем доказано, что двойная связь равномерно распределена между двумя атомами кислорода. Степень окисления азота в
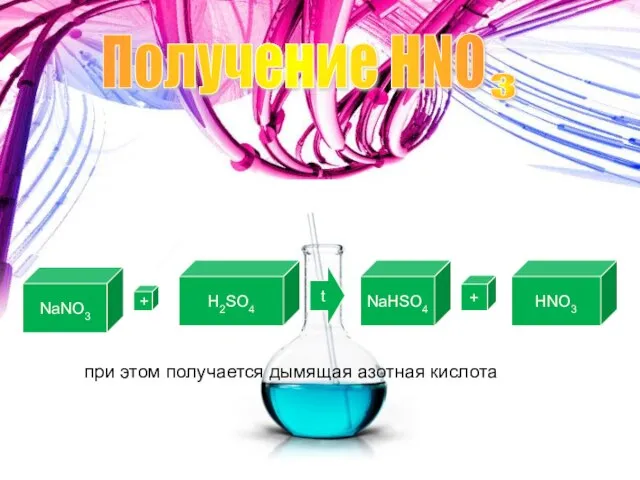
- 7. Получение HNO 3 Лабороторный способ получения: NaNO3 + H2SO4 t NaHSO4 + HNO3 при этом получается
- 8. Промышленный способ 1. Окисления аммиaка в NO в присутствии платино-родиевого катализатора: 4NH3 + 5O2 = 4NO
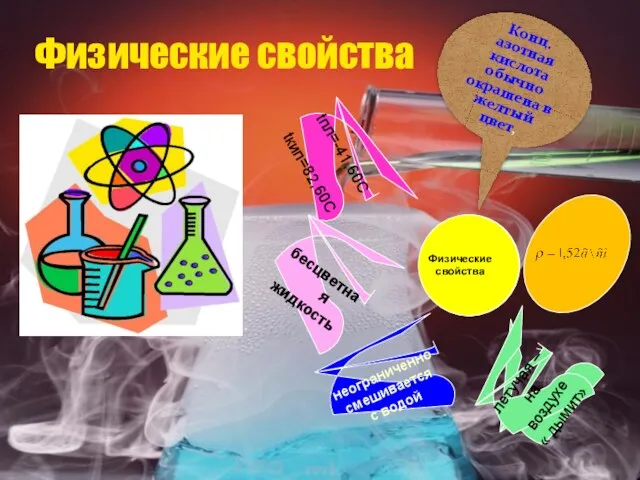
- 9. Физические свойства Физические свойства бесцветная жидкость tпл=-41,60C tкип=82,60C неограниченно смешивается с водой летучая – на воздухе
- 10. Исследования (задания по группам): (Повторение ПТБ!). 1 группа: провести реакцию раствора азотной кислоты и оксида меди
- 11. Группа №1 CuO + 2 HNO3 = Cu(NO3)2 + H2O - реакция ионного обмена, необратимая CuO
- 12. Общие с другими кислотами: 1. Сильный электролит, хорошо диссоциируют на ионы HNO3 -> H+ +NO3- Изменяет
- 13. Специфические: При нагревании и под действием света разлагается 4HNO3 = 2H2O + 4NO2 + O2 Реагирует
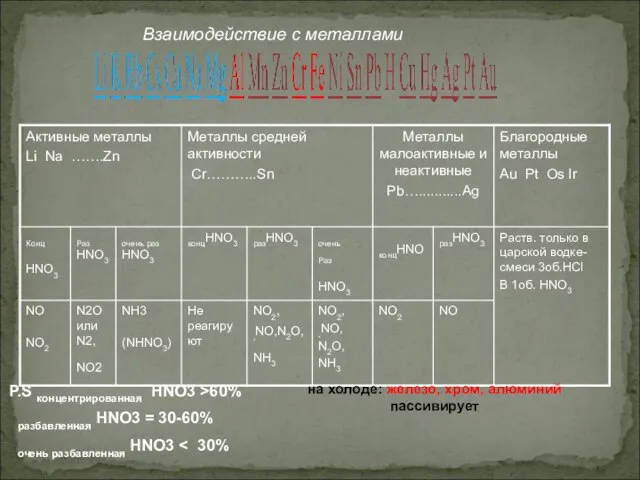
- 14. Взаимодействие азотной кислоты с металлами изучено довольно хорошо, т.к. конц. HNO3 используется в качестве окислителя ракетного
- 15. Взаимодействие с металлами: При взаимодействии с металлами образуются нитрат, вода и третий продукт по схеме: HNO3(р.)+Me(до
- 16. P.S концентрированная HNO3 >60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 на холоде: железо, хром, алюминий
- 17. Применение Азотной кислоты: - производство азотных и комбинированных удобрений, -взрывчатых веществ (тринитротолуола и др.), -органических красителей.
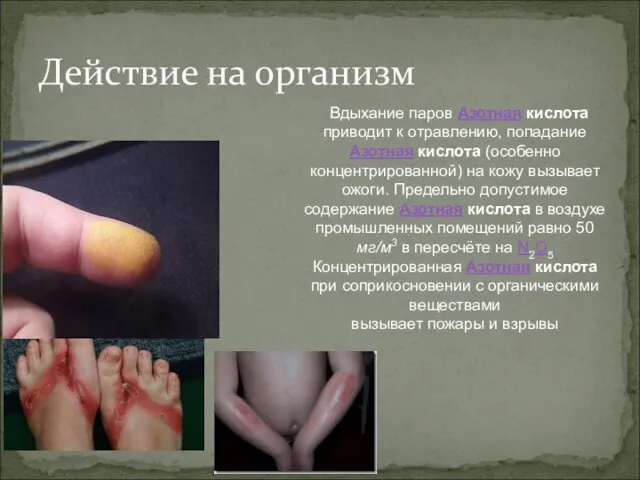
- 18. Действие на организм Вдыхание паров Азотная кислота приводит к отравлению, попадание Азотная кислота (особенно концентрированной) на
- 19. Проверь себя: Степень окисления азота в HNO3 а)-3 б)0 в)+5 г)+4 При хранении на свету HNO3
- 20. 1 - в 2 - б 3 - а 4 - а 5 - б ключ
- 21. вывод: 1. Азотной кислоте характерны общие свойства кислот: реакция на индикатор, взаимодействие с оксидами металлов, гидроксидами,
- 22. Домашнее задание: §26 упр 4,5 Творческое задание –презентация история открытия азотной кислоты. Применение азотной кислоты
- 23. Спасибо за урок
- 25. Скачать презентацию













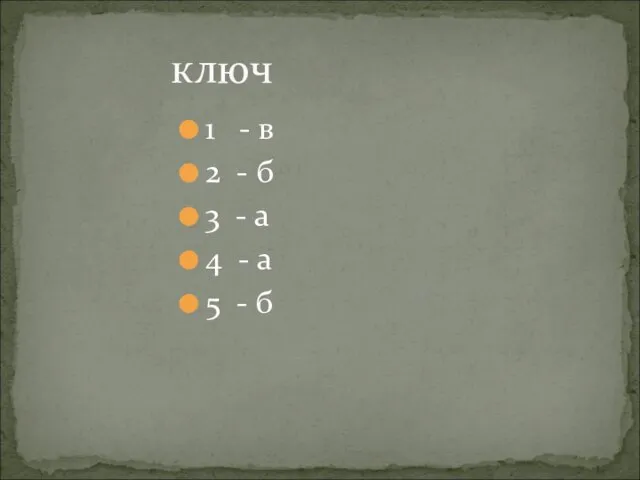



 Получение и применение алкадиенов
Получение и применение алкадиенов Проект в сфере экологического волонтерства преподавателя химии первой квалификационной категории
Проект в сфере экологического волонтерства преподавателя химии первой квалификационной категории Теоретические основы органической химии. Лекция 25
Теоретические основы органической химии. Лекция 25 Соли азотной кислоты – нитраты. Нитриты, Азотные удобрения
Соли азотной кислоты – нитраты. Нитриты, Азотные удобрения Относительная атомная и молекулярная масса
Относительная атомная и молекулярная масса Вклад учёных-химиков в Великую победу
Вклад учёных-химиков в Великую победу Презентация на тему Генетическая связь между классами неорганических вещ-в
Презентация на тему Генетическая связь между классами неорганических вещ-в  Типы кристаллических структур Автор Могилевская А.Е. Санкт-Петербург. ГБОУ СОШ№535
Типы кристаллических структур Автор Могилевская А.Е. Санкт-Петербург. ГБОУ СОШ№535 Основания и кислоты в повседневной жизни
Основания и кислоты в повседневной жизни Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Агрегатные состояния веществ
Агрегатные состояния веществ Путешествие в страну Металлию. Тест по химии
Путешествие в страну Металлию. Тест по химии Валентность (от латинского valentia – сила)
Валентность (от латинского valentia – сила) 8_ANIONY_2_3_angr
8_ANIONY_2_3_angr h-m-chniy-zv-yazok-budova-rechovin
h-m-chniy-zv-yazok-budova-rechovin Химическое равновесие. Задачи
Химическое равновесие. Задачи Разбор задач
Разбор задач Алкадиены, каучуки
Алкадиены, каучуки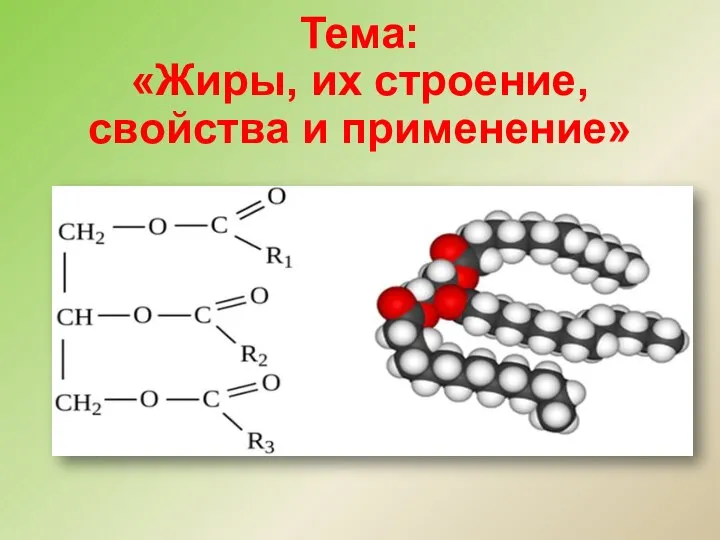 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Классификация оксидов
Классификация оксидов Щелочные металлы
Щелочные металлы Закон Гесса. Термохимические уравнения
Закон Гесса. Термохимические уравнения Комплексные соединения
Комплексные соединения Презентация на тему Растворы (11 класс)
Презентация на тему Растворы (11 класс)  Введение в органическую химию
Введение в органическую химию Арены
Арены Составление формул солей
Составление формул солей Молярный объем газов
Молярный объем газов