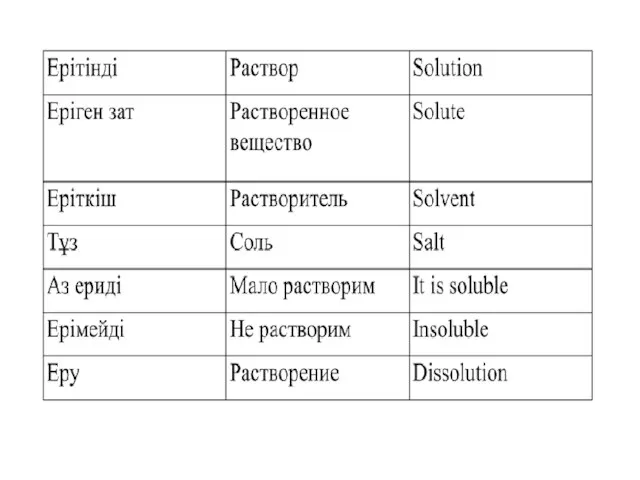
Содержание
- 2. Цели обучения: -классифицировать вещества по растворимости в воде -объяснять роль растворов в природе и повседневной жизни
- 4. Растворы – однородные системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические
- 5. Растворение Физический процесс – результат диффузии веществ Химический процесс –взаимодействие вещества с водой и образование гидратов
- 6. Растворимость - это способность вещества образовывать с другими веществами (растворителями) однородные системы – растворы
- 7. Природа растворенного вещества Вещества хорошо растворимые (в 100г H2O больше 1г вещества) нерастворимые (в 100г H2O
- 9. Скачать презентацию





 Кабинет химии
Кабинет химии Тест по неметаллам
Тест по неметаллам Непредельные карбоновые кислоты
Непредельные карбоновые кислоты Предельные одноатомные спирты
Предельные одноатомные спирты Простые вещества - металлы
Простые вещества - металлы Возможности модернизации совместного производства фенола и ацетона кумольным способом
Возможности модернизации совместного производства фенола и ацетона кумольным способом Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"  Определение времени прохождения диффузии
Определение времени прохождения диффузии Алкины
Алкины Химическая связь
Химическая связь Термодинамика и теплопередача. Реальные газы
Термодинамика и теплопередача. Реальные газы Вода. Физические свойства воды
Вода. Физические свойства воды Водород. Свойства, применение
Водород. Свойства, применение Химическая связь
Химическая связь Аналитическая химия
Аналитическая химия ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы
ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы Моющие и чистящие средства
Моющие и чистящие средства Физическое явление в химии
Физическое явление в химии Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Биосенсоры. Основные принципы (лекция 2)
Биосенсоры. Основные принципы (лекция 2) Правила заполнения орбиталей электронами
Правила заполнения орбиталей электронами Строение электронных оболочек атома
Строение электронных оболочек атома Типы химических реакций
Типы химических реакций Флэшмоб: Лаборатория на кухне
Флэшмоб: Лаборатория на кухне Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Кислоты. Классификация кислот
Кислоты. Классификация кислот Курсовая работа. Синтез адипиновой кислоты
Курсовая работа. Синтез адипиновой кислоты Химическое равновесие и способы его смещения. Принцип Ле Шателье. 9 класс
Химическое равновесие и способы его смещения. Принцип Ле Шателье. 9 класс