Слайд 2Цель работы:
провести наблюдение за протеканием окислительно-восстановительных реакций различного типа
отработать навыки составления уравнений

методом электронного баланса и методом полуреакций
отметить значение и области применения реакций для человека и научно-технического прогресса.
Слайд 3Опыт № 1
Окислительные свойства соляной кислоты

Слайд 4Приборы и реактивы10%-ный раствор соляной кислоты HCl, гранулированный металлический цинк, пробирка, лучинка.
Ход

работы: В соляную кислоту HCl объемом 1 мл бросить кусочек металлического цинка.
https://youtu.be/cBV-t5ISO2E
Слайд 5Опишите наблюдаемый эффект.
Какой выделяется газ?
Напишите уравнения протекающей реакции, составьте уравнения

полуреакций методом электронного баланса, расставьте коэффициенты в уравнении.
Определите окислитель и восстановитель и соответствующие им процессы, а также тип окислительно – восстановительной реакции
Сделайте вывод.
Слайд 6Опыт № 2
Окислительные свойства катионов железа Fe3+

Слайд 7Приборы и реактивы:
1%-ный раствор иодида калия KI, 5%-ный раствор хлорида железа (III)

FeCl3, дистиллированная вода, крахмальный клейстер.
Ход работы:
К 0,5 мл раствора йодида калия KI прибавить такой же объем раствора хлорида железа (III) FeCl3, разбавить водой до 2 мл и добавить несколько капель крахмального клейстера.
https://youtu.be/cas_vrRoW_4
Слайд 8Опишите наблюдаемый эффект.
Напишите уравнения протекающей реакции, составьте уравнения полуреакций методом электронного

баланса.
Определите окислитель и восстановитель и соответствующие им процессы, расставьте коэффициенты в уравнении.
Укажите тип окислительно –восстановительной реакции
Сделайте вывод.
Слайд 9Опыт № 3
Восстановительные свойства железа

Слайд 10Приборы и реактивы:
10%-ный раствор азотной кислоты HNO3, железный гвоздик, 1%-раствор роданида

калия KCNS, спиртовка, держатель.
Ход работы:
Очищенный и обезжиренный в ацетоне железный гвоздик положить в 10%-ный раствор разбавленной азотной кислоты HNO3. Слегка подогрейте пробирку до начала реакции. Через некоторое время раствор желтеет.
Для обнаружения катионов железа (III), добавьте 1-2 капли 1%-ного раствора роданида калия KCNS. Если в растворе присутствуют катионы железа (III), то раствор окрасится в вишнево-красный цвет.
https://youtu.be/nXzyFwI9vxo
Слайд 11Опишите наблюдаемый эффект. Почему раствор желтеет? Какой выделяется газ? В присутствии каких

ионов раствор роданида калия изменяет свою окраску?
Напишите уравнение реакции взаимодействия железа с разбавленной азотной кислотой, составьте уравнения полуреакций методом электронного баланса.
Определите окислитель и восстановитель и соответствующие им процессы, тип окислительно – восстановительной реакции
Сделайте вывод.
Слайд 12Опыт № 4
Окислительно-восстановительная двойственность перекиси водорода H2O2

Слайд 13Приборы и реактивы:
2%-ный раствор иодида калия KI, 10%-ный раствор серной кислоты

H2SO4, 3%-ный раствор перекиси водорода H2O2. крахмальный клейстер, насыщенный раствор перманганата калия KMnO4, лучинка.
Слайд 14Ход работы:
а) К 0,5 мл 2%-ного раствора иодида калия KI прибавить такой

же объем 10%-ной серной кислоты H2SO4 и несколько капель 3%-ного раствора перекиси водорода H2O2. Выделяется свободный йод, который можно обнаружить с помощью крахмального клейстера.
https://youtu.be/Zkujzy5pehc
Слайд 15Опишите наблюдаемый эффект. Какой выделяется газ? В присутствии какого соединения раствор крахмала

изменяет свою окраску? Какие свойства проявляет в этой реакции перекись водорода H2O2?
Напишите уравнение реакции взаимодействия перекиси водорода и йодида калия.
Определите окислитель и восстановитель, составьте электронно – ионные уравнения полуреакций, укажите соответствующие им процессы, расставьте коэффициенты.
Укажите тип окислительно –восстановительной реакции
Слайд 16Ход работы:
б) В пробирку с 0.5 мл насыщенного раствора перманганата калия KMnO4

прилить такое же количество 10%-ного раствора серной кислоты H2SO4 и несколько капель 3%-ного раствора перекиси водорода H2O2 до обесцвечивания.
Поднесите тлеющую лучинку к отверстию пробирки и оставьте в этом положении некоторое время
https://youtu.be/TDtzRNKQ1bY
Слайд 17Опишите наблюдаемый эффект. Какой выделяется газ? Какие свойства проявляет в этой реакции

перекись водорода H2O2?
Напишите уравнение реакции взаимодействия перекиси водорода и перманганата калия в сернокислой среде.
Определите окислитель и восстановитель, составьте электронно – ионные уравнения полуреакций, укажите соответствующие им процессы, расставьте коэффициенты в уравнении.
Укажите тип окислительно –восстановительной реакции
Слайд 18Изучение реакции диспропорционирования
Опыт № 5

Слайд 19Приборы и реактивы: 10%-ный раствор гидроксида натрия, 10%-ный раствор серной кислоты H2SO4

, кристаллический йод.
Ход работы:
а) К нескольким небольшим кристаллам йода прибавить 2-3 мл NaOH. Перемешивая содержимое пробирки, добиться полного растворения йода. Прибавить 2-3 мл H2SO4.
https://youtu.be/j5F-y6Xy8gk
Слайд 20Опишите наблюдаемый эффект в результате взаимодействия йода и щелочи. Какое соединение образовалось

в пробирке? Какие свойства проявляет йод в данной реакции?
Опишите наблюдаемый эффект после прибавления серной кислоты к содержимому пробирки. Какие свойства проявляют соединения йода в данной реакции?
Напишите уравнение реакции взаимодействия йода и щелочи. Определите окислитель и восстановитель, составьте электронно – ионные уравнения полуреакций, укажите соответствующие им процессы, расставьте коэффициенты в уравнении.
Слайд 21Напишите уравнение реакции взаимодействия соединения йода и кислоты. Определите окислитель и восстановитель,

составьте электронно – ионные уравнения полуреакций, укажите соответствующие им процессы, расставьте коэффициенты в уравнении.
Определите типы окислительно-восстановительных реакций в обоих случаях.
Сделайте вывод о связи свойств йода и его соединений с возможностью участия в различных типах окислительно-восстановительных реакциях.
Слайд 22Опыт № 6
Изучение реакции внутримолекулярного окисления-восстановления

Слайд 23Приборы и реактивы:
кристаллический (NH4)2Cr2O7 .
Ход работы:
Порошок (NH4)2Cr2O7 насыпьте горкой на металлический

лист или асбестового картона (можно использовать кафельную плитку). Сделайте углубление на вершине в виде «кратера» и налейте туда 1 мл спирта. Подожгите спирт. Какие соединения образуются? Составьте уравнение химической реакции. Определите тип протекающей химической реакции.
https://youtu.be/-m_pLYtDPlQ
Слайд 24Опишите наблюдаемый эффект в результате разложения бихромата аммония. Почему наблюдается увеличение объема

горки соли? Какое газообразное соединение образовалось? Можно ли назвать данный процесс самопроизвольным? Какие свойства проявляет бихромата аммония в данной реакции?
Напишите уравнение реакции разложения бихромата аммония. Определите окислитель и восстановитель, составьте электронно – ионные уравнения полуреакций, укажите соответствующие им процессы, расставьте коэффициенты в уравнении.
Укажите тип окислительно –восстановительной реакции
Слайд 25Контрольные вопросы
1. Какие химические реакции относятся к окислительно-восстановительным?
2. Что такое степень окисления

химического элемента?
3. Что называется процессом окисления (восстановления)? Сформулируйте понятие окислителя и восстановителя.
4. Какие вещества проявляют окислительно-восстановительную двойственность?
5. Учитывая степени окисления атомов элементов (не проводя расчета) возможность протекания окислительно-восстановительных реакций между следующими веществами: HNO3 (конц.) и P2O5; HNO3 (конц.) и HClO4; HBrO3 и H3PO4; HI и H2S; HN3 и HCl.
























 Изучение свойств анилина. Лабораторная работа №18
Изучение свойств анилина. Лабораторная работа №18 Увлекательный мир науки и практики
Увлекательный мир науки и практики Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Введение в химию. Вещества. Факультатив по химии для учащихся 7 класса
Введение в химию. Вещества. Факультатив по химии для учащихся 7 класса Алканы. Физические свойствава алканов
Алканы. Физические свойствава алканов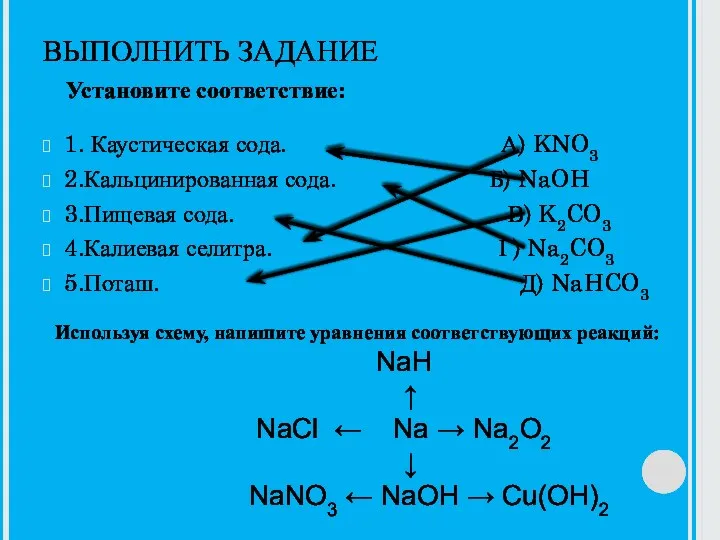 Каустическая сода
Каустическая сода Продукты и процессы переработки нефти
Продукты и процессы переработки нефти Reshenie_zadach
Reshenie_zadach Химические свойства алканов
Химические свойства алканов Подготовка к ГИА 2021
Подготовка к ГИА 2021 Азотная кислота
Азотная кислота Ионная связь
Ионная связь Азотная кислота
Азотная кислота Земная спираль Шанкуртуа
Земная спираль Шанкуртуа Предмет химии, простые и сложные вещества
Предмет химии, простые и сложные вещества Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Диеновые углеводороды
Диеновые углеводороды Селективность (реакторы)
Селективность (реакторы) Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Презентация на тему Химия и музыка 11 класс
Презентация на тему Химия и музыка 11 класс  Растворение. Экспериментальная работа с веществами
Растворение. Экспериментальная работа с веществами Классификация неорганических веществ
Классификация неорганических веществ Phosphorus
Phosphorus Кремний и его соединения
Кремний и его соединения Строение и физические свойства металлов
Строение и физические свойства металлов Структура и функции нуклеиновых кислот
Структура и функции нуклеиновых кислот Синтез макромолекул
Синтез макромолекул Жиры
Жиры