Содержание
- 3. 1 закономерность – чем меньше радиус атома, тем ярче проявляются неметаллические свойства и наоборот.
- 4. Электронное строение атома неона +10 2 1s22s22р6 1s 8 2s 2р
- 5. 1 закономерность – чем меньше радиус атома, тем ярче проявляются неметаллические свойства и наоборот. 2 закономерность
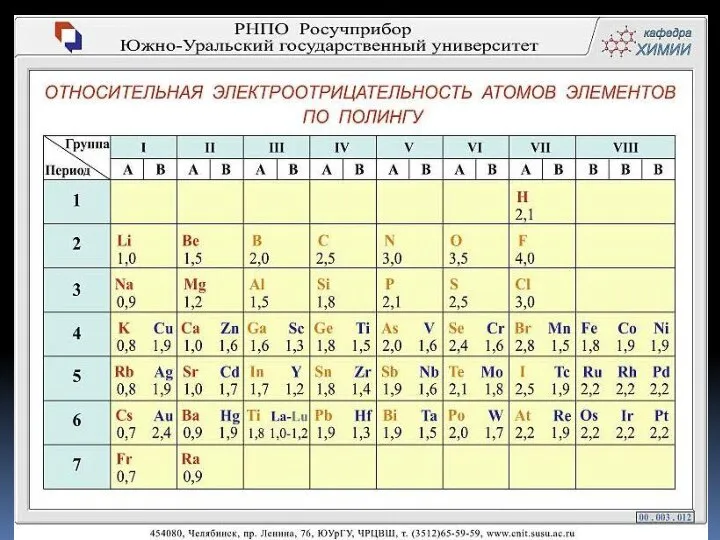
- 6. Электроотрицательность (ЭО) – свойство атома данного элемента оттягивать на себя электроны от атомов других элементов в
- 7. Современное понятие об электроотрицательности атомов было введено американским химиком Лайнусом Полингом.
- 8. 1 закономерность – чем меньше радиус атома, тем ярче проявляются неметаллические свойства и наоборот. 2 закономерность
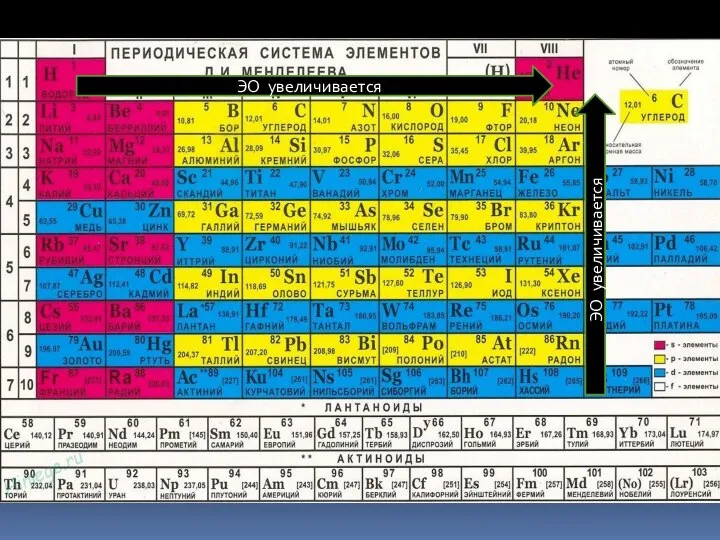
- 9. ЭО увеличивается ЭО увеличивается
- 11. Скачать презентацию






 Презентация на тему Вещества и их свойства
Презентация на тему Вещества и их свойства  Валентность
Валентность Роль химии в Великой Отечественной войне
Роль химии в Великой Отечественной войне Материаловедение. Адсорбционные материалы. Металлоорганические каркасы
Материаловедение. Адсорбционные материалы. Металлоорганические каркасы Моделирование деформаций углеродных слоёв при функционализации технического углерода
Моделирование деформаций углеродных слоёв при функционализации технического углерода Обобщение темы Органические вещества. Классификация органических веществ по углеродному скелету
Обобщение темы Органические вещества. Классификация органических веществ по углеродному скелету Жиры. 10 класс
Жиры. 10 класс Степень окисления. Составление формул бинарных соединений
Степень окисления. Составление формул бинарных соединений Спирт и его влияние на организм человека
Спирт и его влияние на организм человека Алканы. Зачетная работа
Алканы. Зачетная работа Чугуны
Чугуны Дивный мир турмалинов
Дивный мир турмалинов Металлы побочных подгрупп
Металлы побочных подгрупп Полимерные материалы
Полимерные материалы Техника безопасности (3)
Техника безопасности (3) Комплексонометрическое титрование. 5 лекция. Часть 2
Комплексонометрическое титрование. 5 лекция. Часть 2 Концентрации растворов и эквиваленты веществ
Концентрации растворов и эквиваленты веществ Круговорот азота
Круговорот азота Структура електронної оболонки атома. Енергетичні рівні та підрівні
Структура електронної оболонки атома. Енергетичні рівні та підрівні Вторичная переработка нефти. Риформинг
Вторичная переработка нефти. Риформинг Кинетика химических реакций и химическое равновесие. Лекция №4
Кинетика химических реакций и химическое равновесие. Лекция №4 Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Учебник системы учебно-методических комплектов Алгоритм успеха
Учебник системы учебно-методических комплектов Алгоритм успеха Соли
Соли Хромофорная теория кислотно-основных индикаторов
Хромофорная теория кислотно-основных индикаторов Спирты
Спирты Поликарбонат мономерлері
Поликарбонат мономерлері Соли азотной кислоты- нитраты
Соли азотной кислоты- нитраты