Слайд 2Вещество – это любая совокупность атомов и (или) молекул
Атом – электро-нейтральная частица,

состоящая из взаимодействующих положительно заряженного ядра и отрицательно заряженных электронов
Ядро атома (нуклид)- состоит из протонов и нейтронов
Химический элемент- определенный вид атомов, имеющий одинаковый заряд ядра.
Число протонов – соответствует порядковому номеру элемента в периодической системе
Массовое число – сумма протонов и нейтронов.
Изотопы – атомы, имеющие одинаковый заряд ядра, но разные массовые числа
Слайд 3Простые вещества – вещества, образованные атомами одного элемента
Аллотропы – когда один элемент

может образовывать несколько простых веществ (аллотропные модификации).
Сложные вещества - образованы атомами разных элементов и имеют состав либо постоянный (дальтониды) либо меняющийся в некоторых пределах (бертолиды).
Кристаллическая решетка- вещества в твердом состоянии образуют трехмерную упорядоченность частиц .
Слайд 4Молекула –наименьшая электронейтральная замкнутая совокупность атомов, образующих определенную структуру с помощью химических

связей.
Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
ИНТЕНСИВНЫЕ параметры - величины которых не зависят от размера системы (порции вещества)(давление температура плотность массовая доля).
ЭКСТЕНСИВНЫЕ параметры – числовые значения которых зависят от размера системы. (Масса, объем, количество вещества)
Слайд 5Относительная атомная масса Аr – средневзвешенность массовых чисел природных изотопов данного элемента
Аr=

mp+mn
Относительная молекулярная масса Мr - безразмерная величина, равная сумме относительных атомных масс элементов всех атомов, составляющих формульную единицу.
Молярная масса М - численно равна относительной молекулярной массе и измеряется в граммах на моль (г/моль)
М = m∙ν
М- граммы m- в граммах
ν- количество вещества в молях
Слайд 6
Моль- единица измерения количества вещества. в 1 моль вещества содержится столькок формульных

единиц, сколько содержится атомов углерода в 12 г изотопа углерода С
Любое вещество количеством 1 моль содержит 6,02∙1023 структурных единиц.
12 г (С) содержит 6,02∙1023 структурных единиц.
6,02∙1023 –число Авагадро.
Na=12г/12∙1,66057∙10-24 = 1/1,66057∙10-24 =6,0221∙1023
Слайд 7Количество вещества
ν(ню) = N/Na
ν(ню) = m/M
ν(ню) = V/Vm
Моль любого газа при

нормальных условиях (н.у) занимает объем 22,4л
Vм = 22,4 л/моль МОЛЯРНЫЙ ОБЪЕМ






 Пайданалылған майларды қолдана отырып көмірді брикеттер алу
Пайданалылған майларды қолдана отырып көмірді брикеттер алу Альфа- и бета- распад. Правило смещения
Альфа- и бета- распад. Правило смещения Альдегиды
Альдегиды Строение атома
Строение атома Номенклатура органических соединений
Номенклатура органических соединений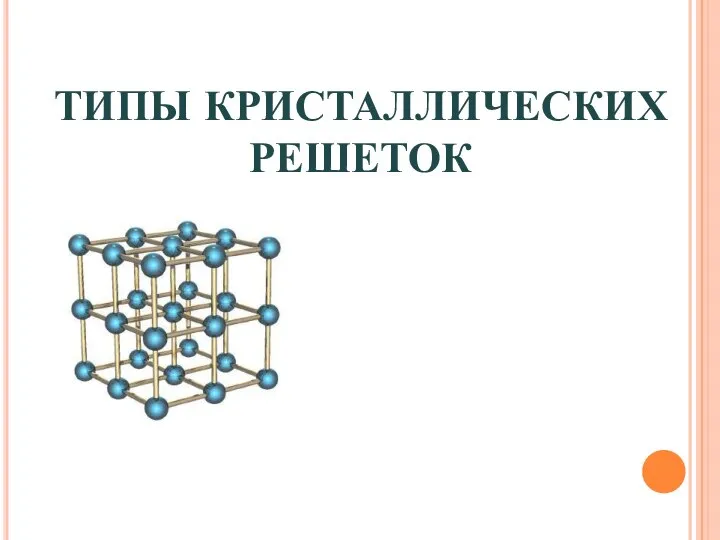 кристаллические решетки (2) (2)
кристаллические решетки (2) (2) Получение аминов
Получение аминов Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Биосинтез кортикостероидов из ацетил КоА и ХС
Биосинтез кортикостероидов из ацетил КоА и ХС Классификация веществ. Кислоты. Основания. Соли
Классификация веществ. Кислоты. Основания. Соли Природный газ
Природный газ Khim_8
Khim_8 Аналитические методы контроля в техносферной безопасности. Лекция 1
Аналитические методы контроля в техносферной безопасности. Лекция 1 Лекция_классы_неогранических_соединений
Лекция_классы_неогранических_соединений Химия - наука чудес и превращений
Химия - наука чудес и превращений Рідкі кристали та їх властивості
Рідкі кристали та їх властивості Добыча золота в России По теме «Внешние эффекты и права собственности»
Добыча золота в России По теме «Внешние эффекты и права собственности» Незаменимая уксусная кислота
Незаменимая уксусная кислота Валентность химических элементов
Валентность химических элементов Амины. Аминокислоты. Белки
Амины. Аминокислоты. Белки Полімери
Полімери Топливоснабжение источников децентрализованного теплоэнергоснабжения
Топливоснабжение источников децентрализованного теплоэнергоснабжения Удивительное рядом
Удивительное рядом Чистые вещества и смеси
Чистые вещества и смеси Ковалентная связь
Ковалентная связь Исследовательская работа по химии на тему: Интегративные проблемные ситуации
Исследовательская работа по химии на тему: Интегративные проблемные ситуации Химия, химия, химия!
Химия, химия, химия! Элементарный химический состав белков
Элементарный химический состав белков