Содержание
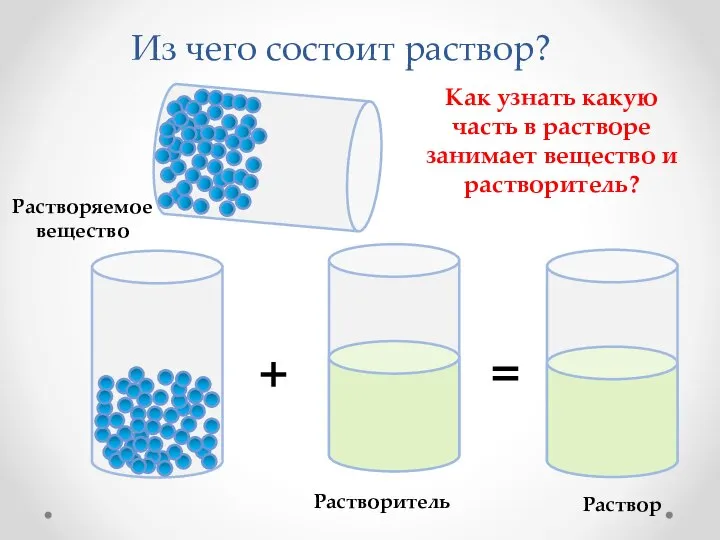
- 2. Из чего состоит раствор? Растворяемое вещество Растворитель + = Раствор Как узнать какую часть в растворе
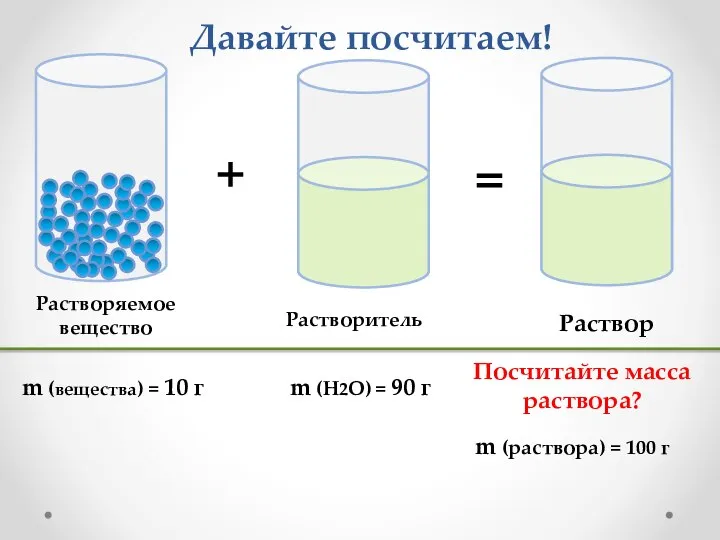
- 3. Давайте посчитаем! m (раствора) = 100 г Посчитайте масса раствора?
- 4. Произведём расчёт в процентах ω (вещества) = 10% ω (H2O) = 90% Всего раствора 100%
- 5. Решение задач Задача 1. Необходимо приготовить 150 г 10% раствора хлорида натрия. Сколько необходимо взять соли
- 6. Задача 2 Вариант 1 Рассчитайте массу бромида калия KBr и воды, для приготовления 200 г 15%
- 7. Решение задач Задача 5. В 500 г раствора, насыщенного при t=20 С, содержится 120 г нитрата
- 9. Скачать презентацию




 Предельные углеводороды
Предельные углеводороды Типичные реакции основных и кислотных оксидов
Типичные реакции основных и кислотных оксидов Физическая химия, термодинамика
Физическая химия, термодинамика Липиды молока и молочных продуктов. Группы липидов
Липиды молока и молочных продуктов. Группы липидов Ароматические углеводороды
Ароматические углеводороды Л-1 основные классы неорганических веществ
Л-1 основные классы неорганических веществ 11 типы связей
11 типы связей Дифференцированный подход в преподавании химии
Дифференцированный подход в преподавании химии Разбор заданий на амины
Разбор заданий на амины Соли. Составление формул и номенклатура
Соли. Составление формул и номенклатура (+)-Plumisclerin A. Плюмисклин А
(+)-Plumisclerin A. Плюмисклин А Природные и искусственные материалы. Естествознание. 6 класс
Природные и искусственные материалы. Естествознание. 6 класс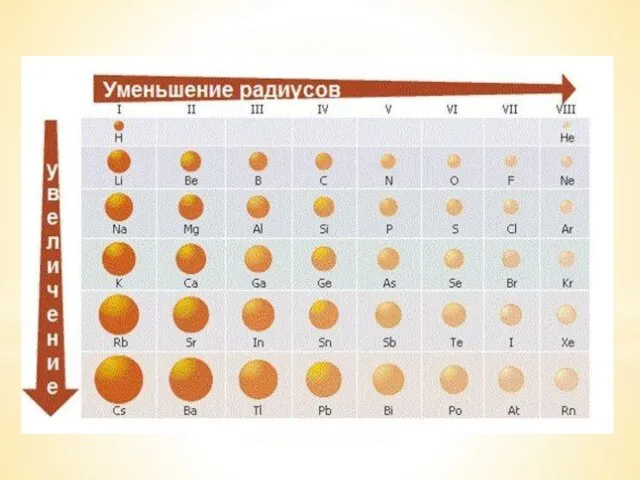 Электроотрицательность химических элементов
Электроотрицательность химических элементов Синтез ацетилена из природного газа в производстве ацетилена
Синтез ацетилена из природного газа в производстве ацетилена Закон сохранения массы веществ
Закон сохранения массы веществ Химические формулы
Химические формулы Карбоновые кислоты. Д.И. Менделеев
Карбоновые кислоты. Д.И. Менделеев Изучение пенопласта
Изучение пенопласта Алюминий и его соединения
Алюминий и его соединения Стелс-материалы
Стелс-материалы Оксиды азота
Оксиды азота Окислительно=восстановительное титрование
Окислительно=восстановительное титрование Алюминий и его свойства
Алюминий и его свойства obschaya_kharakteristika_prostykh_alifaticheskikh_efirov
obschaya_kharakteristika_prostykh_alifaticheskikh_efirov Предмет органической химии
Предмет органической химии Карбоновые кислоты (химические свойства)
Карбоновые кислоты (химические свойства) Использование культурологического компонента на уроках химии
Использование культурологического компонента на уроках химии Алканы
Алканы