Содержание
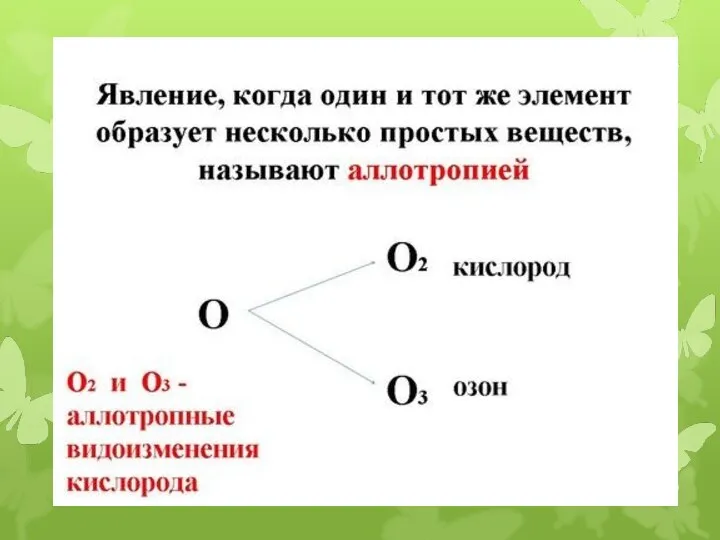
- 2. Цели урока Охарактеризовать положение кислорода и серы в Периодической системе, рассмотреть строение их атомов. Рассмотреть аллотропные
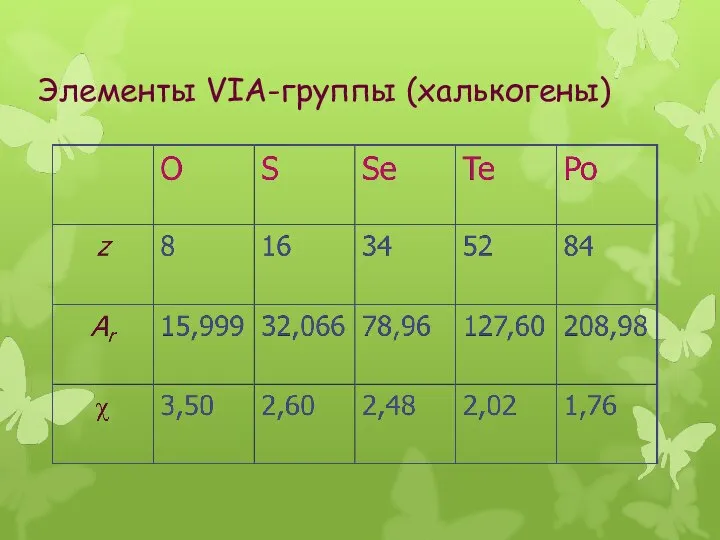
- 3. Элементы VIА-группы (халькогены)
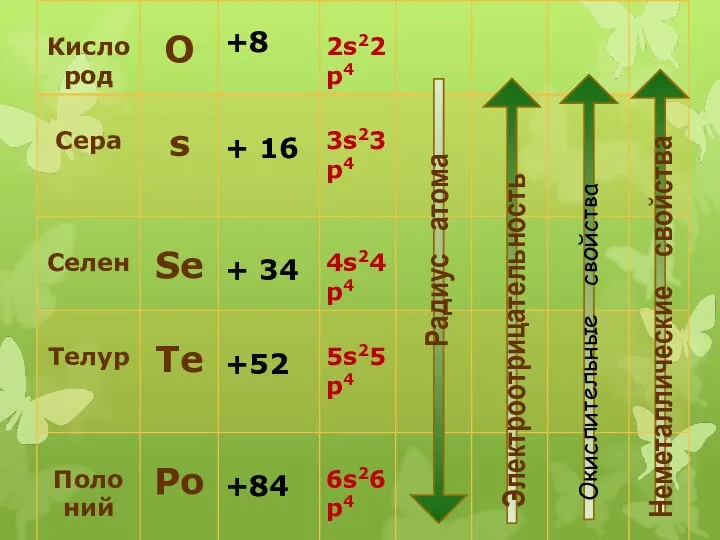
- 4. Общая электронная формула: […] ns 2 (n–1)d 10np 4 Степени окисления: O: –II, –I, 0, +I,
- 5. Окислительные свойства
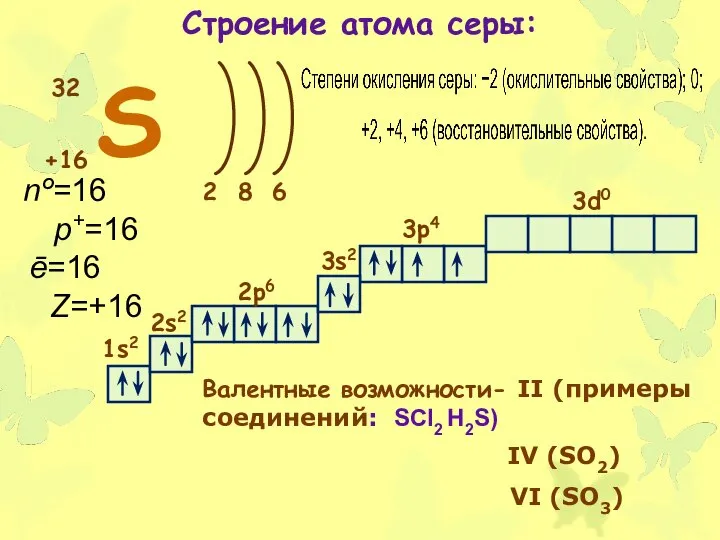
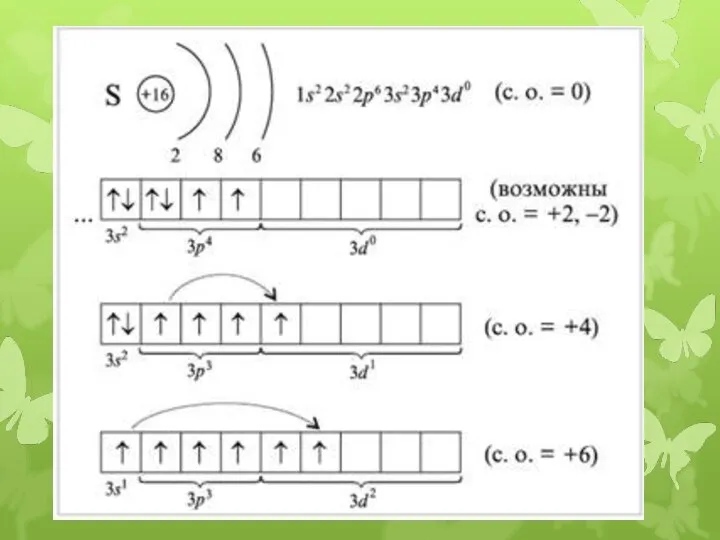
- 7. S +16 32 2 6 8 1s2 2s2 2p6 3s2 3p4 3d0 Валентные возможности- II (примеры
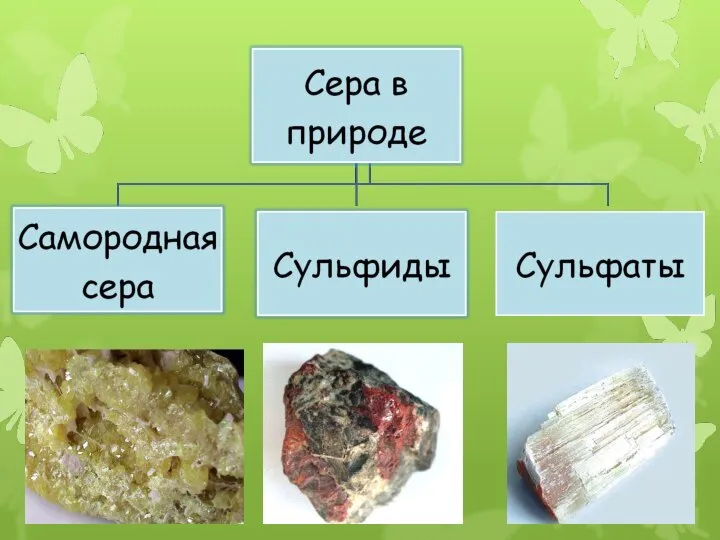
- 10. Нахождение серы в природе По распространённости в земной коре сера занимает пятнадцатое место. Встречается в свободном
- 12. Сульфиды: серный колчедан FeS2, медный колчедан CuFeS2, свинцовый блеск PbS с цинковой обманкой ZnS, пирит FeS2.
- 13. Сульфаты: Гипс-СаSO4*2H2O Мирабилит –Na2SO4*10H2O Горькая соль-MgSO4*7H2O
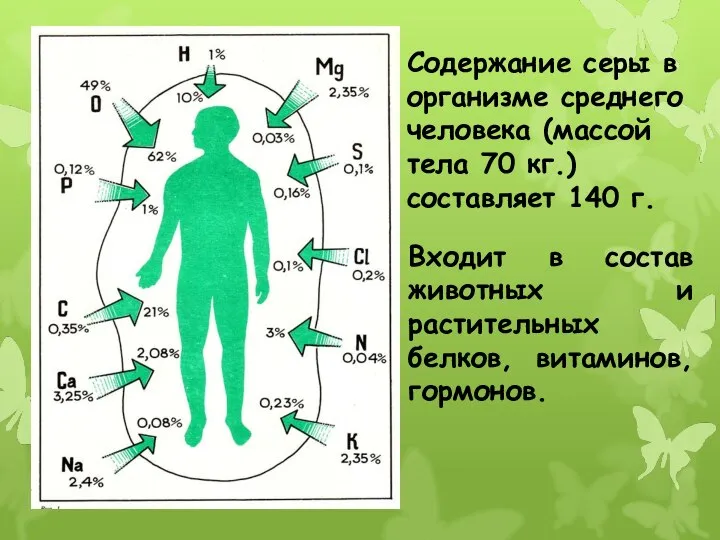
- 14. Содержание серы в организме среднего человека (массой тела 70 кг.) составляет 140 г. Входит в состав
- 15. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера является составной частью биологически активных
- 16. Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца
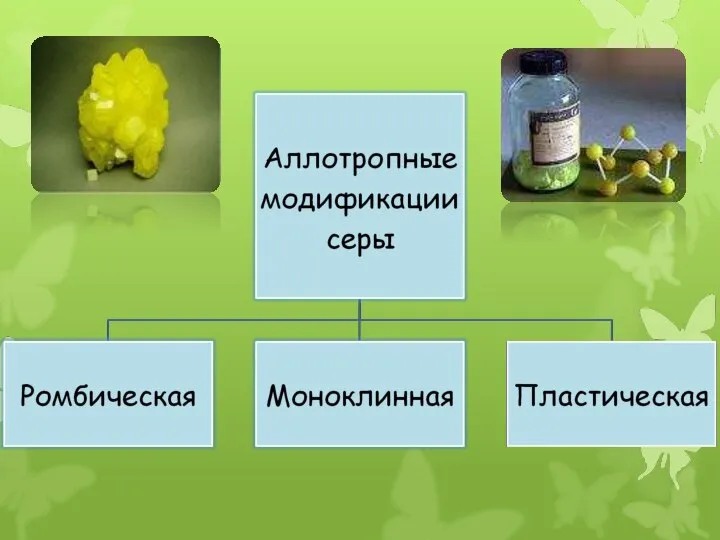
- 18. Ромбическая сера Ромбическая (α-сера) – S8, желтого цвета, t°пл.=113°C; Наиболее устойчивая модификац
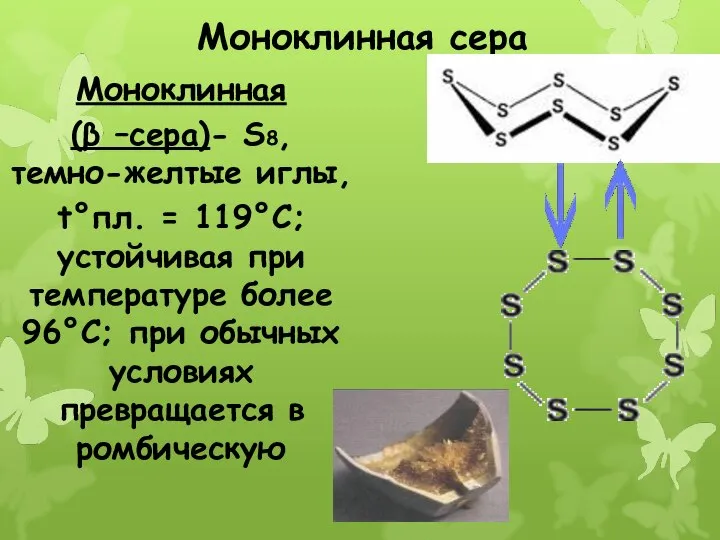
- 19. Моноклинная сера Моноклинная (β –сера)- S8, темно-желтые иглы, t°пл. = 119°C; устойчивая при температуре более 96°С;
- 20. Пластическая сера Пластическая сера- коричневая резиноподобная (аморфная) масса. Она неустойчива и через некоторое время становится хрупкой,
- 21. Задание (письменно). 1. Составить конспект урока. 2. Исправь ошибку и запиши правильно уравнения Na + O
- 23. Скачать презентацию

![Общая электронная формула: […] ns 2 (n–1)d 10np 4 Степени окисления: O:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1025646/slide-3.jpg)









 Степень окисления. Составление формул бинарных соединений. 8 класс
Степень окисления. Составление формул бинарных соединений. 8 класс Технология одноступенчатого гидрокрекинга. Аппаратное оформление и основные технологические решения
Технология одноступенчатого гидрокрекинга. Аппаратное оформление и основные технологические решения Закономерности протеканий химических реакций
Закономерности протеканий химических реакций Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Закон сохранения массы. 11 класс
Закон сохранения массы. 11 класс Введение в химию. Вещества. Факультатив по химии для учащихся 7 класса
Введение в химию. Вещества. Факультатив по химии для учащихся 7 класса Выбор материала для изготовления зубчатых колес
Выбор материала для изготовления зубчатых колес Пластик: польза или вред
Пластик: польза или вред Альдегиды. Получение и применение
Альдегиды. Получение и применение 9-8 кислоты в свете ТЭД (1)
9-8 кислоты в свете ТЭД (1) Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Магматические горные породы
Магматические горные породы Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Алкины (ацетиленовые углеводороды)
Алкины (ацетиленовые углеводороды) Интеллектуальный турнир для старшеклассников Умножая таланты 2020
Интеллектуальный турнир для старшеклассников Умножая таланты 2020 Пятичленные гетероциклы с двумя и более атомами азота
Пятичленные гетероциклы с двумя и более атомами азота Показатели обогащения
Показатели обогащения Минералы и их свойства
Минералы и их свойства α-Аминокислоты
α-Аминокислоты Предельные углеводороды (циклоалканы)
Предельные углеводороды (циклоалканы) Алхимики в Средние века
Алхимики в Средние века Презентация на тему Крахмал
Презентация на тему Крахмал  Изучение основных породообразующих минералов горных пород. Лабораторная работа №1
Изучение основных породообразующих минералов горных пород. Лабораторная работа №1 Область применения карбоновых кислот
Область применения карбоновых кислот Теория химического строения (ТХС). Предпосылки создания
Теория химического строения (ТХС). Предпосылки создания Кремний и его соединения
Кремний и его соединения Reaktsii_ionnogo_obmena
Reaktsii_ionnogo_obmena Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік
Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік