Содержание
- 2. 30 50 70 120 ЦЕЛЬ УРОКА: дать представление о строении, свойствах, применении азотной кислоты ,особенностях ее
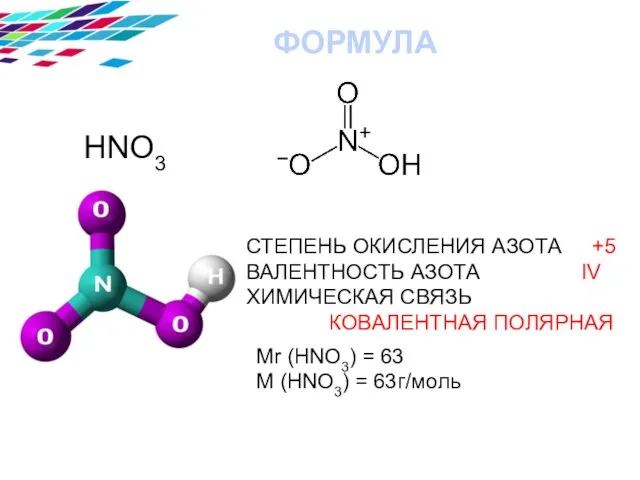
- 3. HNO3 СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА +5 ВАЛЕНТНОСТЬ АЗОТА IV ХИМИЧЕСКАЯ СВЯЗЬ КОВАЛЕНТНАЯ ПОЛЯРНАЯ ФОРМУЛА Mr (HNO3) =
- 4. ИСТОРИЯ ОТКРЫТИЯ Впервые чистую азотную кислоту удалось получить Р. Глауберу в середине XVII в. с помощью
- 5. ПОЛУЧЕНИЕ На производстве: NH3 NO NO2 HNO3 1.Контактное окисление аммиака до оксида азота (II) 4NH3+ 5O2
- 6. ФИЗИЧЕСКИЕ СВОЙСТВА Азотная кислота – бесцветная гигроскопичная жидкость с резким раздражающим запахом, «дымит на воздухе»,неограниченно растворимая
- 7. ХИМИЧЕСКИЕ СВОЙСТВА Общие свойства 1. Действие на индикаторы 2. Диссоциация HNO3 = H+ + NO3- 3.
- 8. ХИМИЧЕСКИЕ СВОЙСТВА Специфические свойства 1. Взаимодействие с металлами
- 9. ХИМИЧЕСКИЕ СВОЙСТВА Специфические свойства 1. Взаимодействие с металлами 4Zn+ 9 HNO3 (разб) = 4Zn(NO3)2 + NH3
- 10. Специфические свойства 2. Разложение на свету или при нагревании 4HNO3 = 4NO2 + O2 + 2H2O
- 11. ПРИМЕНЕНИЕ для получения красителей для получения лекарственных препаратов для получения полимеров при производстве фотопленки для получения
- 12. 3-й класс опасности (умеренно опасная) Вдыхание ее паров приводит к раздражению дыхательных путей. При попадании на
- 13. ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА Выберите, какие из перечисленных свойств характеризуют физические свойства азотной кислоты: Твердое агрегатное состояние;
- 14. ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА 2. Назовите вещества, с которыми может реагировать азотная кислота, запишите соответствующие уравнения реакций:
- 15. ДОМАШНЕЕ ЗАДАНИЕ § 27 (с.156-157), выучить записи в тетради Базовый уровень сложности: с.158 № 2 Повышенный
- 16. СПАСИБО ЗА УРОК !
- 18. Скачать презентацию














 Горный хрусталь
Горный хрусталь Основания. Равновесия в растворах
Основания. Равновесия в растворах Спирты и их производные
Спирты и их производные Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Уретановый каучук
Уретановый каучук Сера и ее соединения
Сера и ее соединения Интерактивная интеллектуальная игра. Юный химик
Интерактивная интеллектуальная игра. Юный химик Минералы
Минералы Кислоты. Состав кислот, их классификация и физические свойства, 8 класс
Кислоты. Состав кислот, их классификация и физические свойства, 8 класс Дизайн молекулярных магнетиков
Дизайн молекулярных магнетиков Диспропроциялану реакциялары
Диспропроциялану реакциялары Презентация на тему Азотная кислота и ее соли (9 класс)
Презентация на тему Азотная кислота и ее соли (9 класс)  Молибден. Получение молибдена
Молибден. Получение молибдена Галогены и их соединения
Галогены и их соединения Аминоксилоты. Общая формула аминокислот
Аминоксилоты. Общая формула аминокислот Презентация на тему Щелочные металлы
Презентация на тему Щелочные металлы  Презентация на тему Лекарства
Презентация на тему Лекарства  Общие свойства растворов
Общие свойства растворов Галогениды, нитраты и сульфаты лантаноидов
Галогениды, нитраты и сульфаты лантаноидов Вклад Д.И. Менделеева в науку
Вклад Д.И. Менделеева в науку Упражнения. Масс-спектрометрия
Упражнения. Масс-спектрометрия Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Производственно-торговая компания ООО СОЖ Синтез-Набережные Челны
Производственно-торговая компания ООО СОЖ Синтез-Набережные Челны Жаропрочные и жаростойкие стали
Жаропрочные и жаростойкие стали Презентация на тему Химические свойства алкенов
Презентация на тему Химические свойства алкенов  Скорость химической реакции. 9 класс
Скорость химической реакции. 9 класс Относительная атомная масса
Относительная атомная масса Презентация на тему Строение газообразных, жидких и твердых тел
Презентация на тему Строение газообразных, жидких и твердых тел