Содержание
- 2. HNO3 1. Бесцветная жидкость. 2. «Дымит» на воздухе и окрашивается в жёлтый цвет. 3. Обладает резким
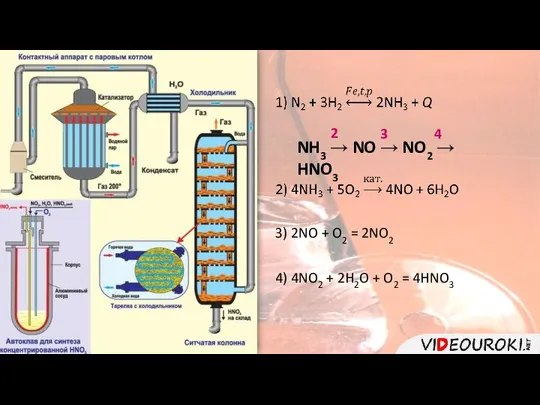
- 3. NH3 → NO → NO2 → HNO3 2 3 4 3) 2NO + O2 = 2NO2
- 4. В лаборатории: H2SO4(конц.) + NaNO3(тв.) = HNO3↑ + NaHSO4 t И. Р. Глаубер «спиритус нутри» ―
- 5. Химические свойства 1. Диссоциация HNO3 → H+ + NO3- 2. Реакции с основными и амфотерными оксидами
- 6. HNO3 +5 концентрированная Не реагирует с Au, Pt Водород не выделяется Fe, Al, Cr пассивируются
- 7. HNO3 +5 разбавленная Не реагирует с Au, Pt Водород не выделяется 3Cu + 8HNO3(разб.) = 3Cu(NO3)2
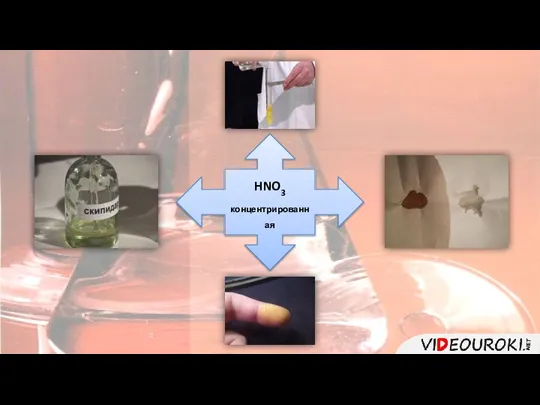
- 8. Концентрированная азотная кислота Разложение Окисление органических веществ HNO3
- 9. HNO3 концентрированная
- 10. Если азотная кислота попала на кожу, то её сразу же нужно промыть большим количеством воды и
- 11. Смесь концентрированной азотной и соляной кислот в объёмном соотношении 1: 3 называется «царской водкой»
- 12. Соли азотной кислоты – нитраты. Нитраты натрия, калия, кальция и аммония называют селитрами. NaNO3 – натриевая
- 13. Получение нитратов Азотная кислота + металлы Азотная кислота + оксиды Азотная кислота + основания Азотная кислота
- 14. Применение
- 15. Азотная кислота – это бесцветная дымящаяся на воздухе жидкость. В промышленности её получают из аммиака, а
- 17. Скачать презентацию












 Открытие Менделеева Д. И
Открытие Менделеева Д. И Получение гидроген хлорида
Получение гидроген хлорида Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева Бикомпонентные покрытия
Бикомпонентные покрытия Неорганические вещества клетки
Неорганические вещества клетки Железо в организме человека. Функции железа в организме
Железо в организме человека. Функции железа в организме Решение задач
Решение задач Валентность. Определение валентности по формулам
Валентность. Определение валентности по формулам Химические знания - в жизнь. Основы нутрициологии
Химические знания - в жизнь. Основы нутрициологии Исследование концентрированных заквасок для сметаны
Исследование концентрированных заквасок для сметаны Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Ароматические углеводороды
Ароматические углеводороды Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Метод ТРИЗ (теория решения изобретательских задач) при обучении химии
Метод ТРИЗ (теория решения изобретательских задач) при обучении химии Аммиак. Азот
Аммиак. Азот Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты)
Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты) Алкадиены: номенклатуры, изомерия. Тест
Алкадиены: номенклатуры, изомерия. Тест Соединения галогенов
Соединения галогенов Основания. Химические свойства.получение
Основания. Химические свойства.получение Степень окисления. Электроотрицательность. Формулы бинарных соединений
Степень окисления. Электроотрицательность. Формулы бинарных соединений Металлы и их соединения
Металлы и их соединения Химические реакции
Химические реакции Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа
Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа Полімери. Пінополістирол
Полімери. Пінополістирол Презентация на тему Амфотерные оксиды и гидроксиды
Презентация на тему Амфотерные оксиды и гидроксиды  Общие химические свойства металлов
Общие химические свойства металлов Способы получения металлов
Способы получения металлов Кинетика химических реакций и химическое равновесие. Лекция №4
Кинетика химических реакций и химическое равновесие. Лекция №4