Содержание
- 3. АТОМНАЯ ОРБИТАЛЬ (АО) - трехмерная область пространства, нахождение электрона в которой наиболее вероятно (90-98%) - каждая
- 4. Принцип Паули Четыре квантовых числа полностью характеризуют движение электрона в атоме: его энергию, форму АО, ориентацию
- 5. Число АО на уровне n2
- 6. Закономерности формирования энергетических уровней и подуровней Принцип минимума энергии Принцип минимума энергии определяет порядок заполнения АО,
- 7. 2. Правило Хунда Минимальной энергии соответствует следующая конфигурация: Она определяет порядок заполнения орбиталей с одинаковой энергией
- 8. 3. Минимум энергии для многоэлектронных подуровней 3. Известно, что минимальная энергия имеет место у подуровней, которые
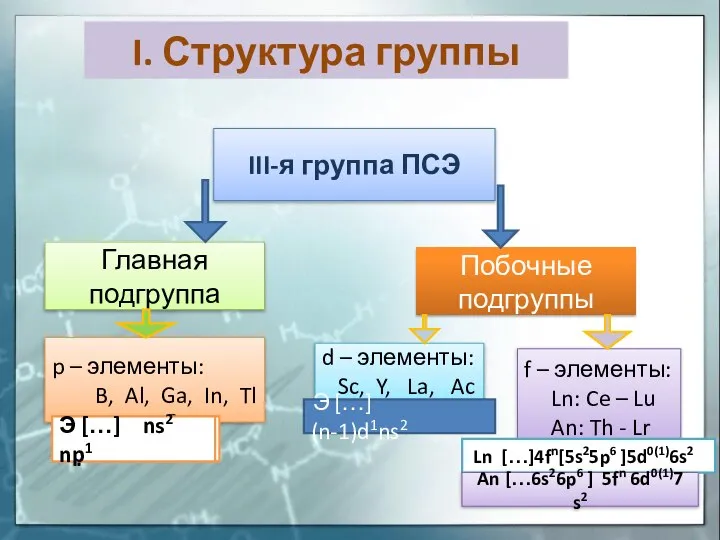
- 9. I. Структура группы III-я группа ПСЭ Главная подгруппа Побочные подгруппы p – элементы: B, Al, Ga,
- 10. Электронное строение лантаноидов 2. Лантаноиды элементы аналоги c близкими свойствами, так как их основное состояние характеризуются
- 11. Электронное строение лантаноидов f-электроны закрыты экраном и не могут вступать в химические взаимодействия, не доступны для
- 12. Характеристика РЗЭ 4. Для некоторых Ln характерна переменная степень окисления. Переменная степень окисления связана со стремлением
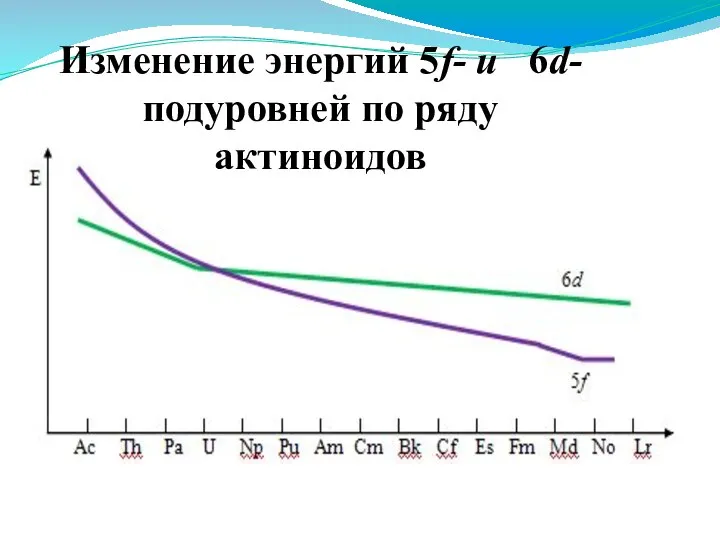
- 14. Электронное строение актиноидов 2. Различие в энергиях 5f- и 6d-орбиталей меньше, чем 4f- и 5d-орбиталей. !!!
- 15. Изменение энергий 5f- и 6d-подуровней по ряду актиноидов
- 16. Особенность электронного строения 4. Для актиноидов первой половины ряда 5 f нестабилен, энергии 5f, 6d ,
- 17. Особенность электронного строения 90Th […6s26p6 ]5f06d2 7s2 !!! U [… 6s 26p6] 5f 36d 17s2 Энергии
- 18. Особенность электронного строения 5. Для актиноидов первой половины семейства возможны переменные степени окисления от +3 до
- 19. Особенность электронного строения 6. Элементы второй половины семейства актиноидов (от кюрия до лоуренсия) вследствие стабилизации 5f-подуровня,
- 20. Химическая связь – совокупность электростатических сил притяжения и отталкивания, создающая динамически устойчивую систему из двух и
- 21. Общие сведения о химической связи Большинство химических элементов, вступая во взаимодействие между собой, стремится приобрести устойчивую
- 22. Общие сведения о химической связи Na + F2 = 2 NaF (механизм ионной связи) F2 +
- 24. Химическая связь 1. Природа сил химической связи – электростатические взаимодействия электронов и ядер совокупность электростатических сил
- 25. Химическая связь принцип минимума энергии При образовании химической связи всегда выделяется энергия Н+Н = Н2 +
- 26. Химическая связь 3. Основные виды химической связи
- 27. Химическая связь К основным видам химической связи относят : ковалентную, ионную, металлическую, (внутримолекулярная водородная связь) (Межмолекулярные
- 28. Химическая связь Ковалентная химическая связь Химическая связь, образованная двумя атомами путем обобществления пары электронов, называется ковалентной
- 29. Химическая связь Металлическая связь Металлическая связь – это химическая связь, обусловленная взаимодействием обобществленных валентные электронов металлов
- 30. 3. Зависимость типа связи от электроотрицательности взаимодействующих атомов.
- 31. Ковалентная связь Особые свойства ковалентной связи Направленность ковалентной связи 1. σ -, π- , δ- это
- 32. ИОННО-МОЛЕКУЛЯРНЫЕ УРАВНЕНИЯ При составлении ионно-молекулярных уравнений реакций следует помнить: 1) малорастворимые, малодиссоциирующие и газообразные вещества записывают
- 33. ИОННО-МОЛЕКУЛЯРНЫЕ УРАВНЕНИЯ Сильные Электролиты (практически полностью диссоциируют на ионы): 1.Сильные кислоты: НNO3, HCl, HBr, HI, HClO4,
- 34. ИОННО-МОЛЕКУЛЯРНЫЕ УРАВНЕНИЯ Слабые электролиты в водных растворах Органические кислоты (CH3COOH, H2C2O4 ,HCOOH и др.), а также
- 35. Термодинамика Термодинамика − это наука, изучающая взаимные превращения различных форм энергии. Она позволяет оценивать вероятность самопроизвольного
- 36. 2. Термодинамические функции состояния Для характеристики химических систем используют функции состояния. Функция состояния (ф.с.) - это
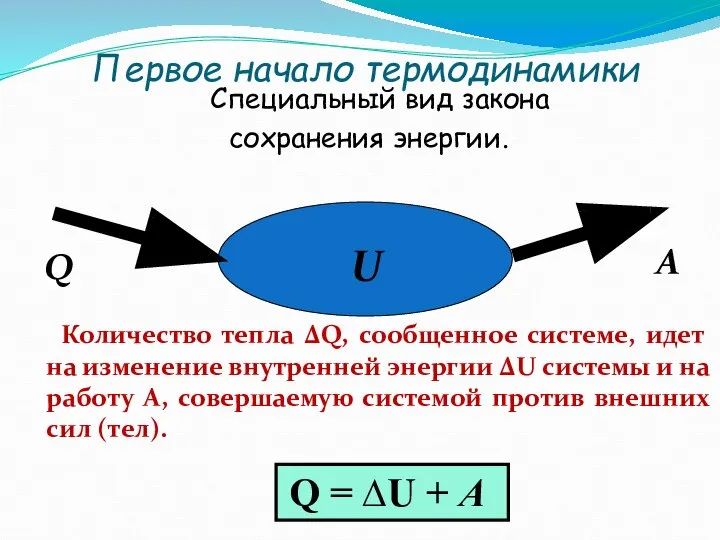
- 37. Первое начало термодинамики Специальный вид закона сохранения энергии. Количество тепла ∆Q, сообщенное системе, идет на изменение
- 38. Законы термохимии Закон Лавуазье, Лапласа (1780). тепловой эффект образования химического соединения равен по величине, но обратен
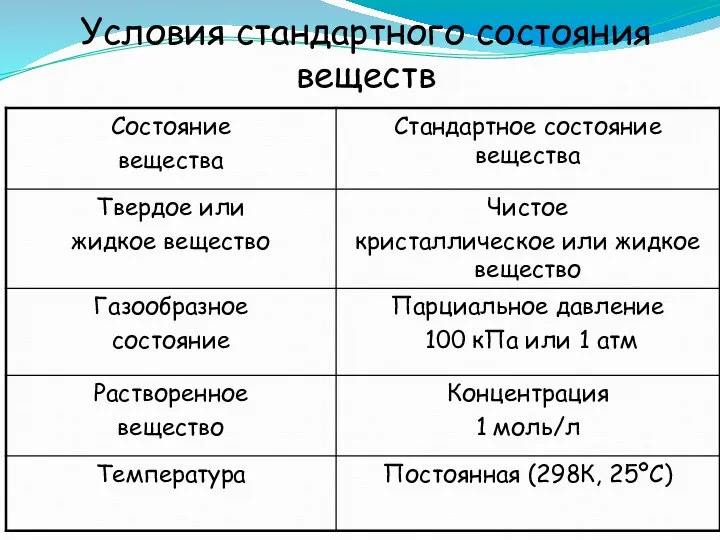
- 39. Условия стандартного состояния веществ
- 40. Стандартные условия Обозначение термодинамических функций приведенных к стандартным условиям ∆H⁰, ∆U⁰, ∆G⁰, ∆S⁰
- 41. Расчетные методы определения тепловых эффектов реакций Расчетные методы определения тепловых эффектов базируются на законах термохимии (Лавуазье,
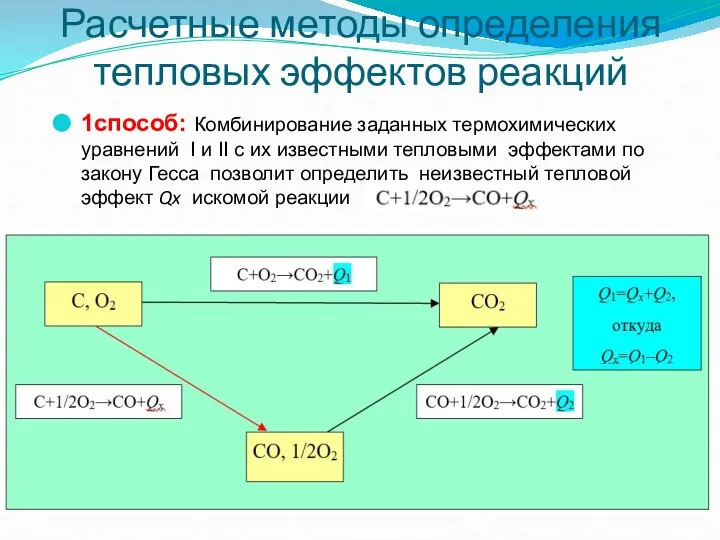
- 42. Расчетные методы определения тепловых эффектов реакций 1способ: Комбинирование заданных термохимических уравнений I и II с их
- 43. Стандартная энтальпия образования 2 способ. Из закона Гесса следует, что при постоянном давлении тепловой эффект химической
- 44. Стандартная энтальпия образования
- 45. Стандартная энтальпия образования 2 способ – это расчет теплового эффекта путем использования справочных данных по стандартным
- 46. Справочные данные ∆H⁰обр Если известны теплоты (энтальпии) образования исходных веществ и продуктов реакции, то можно рассчитать
- 47. СЛЕДСТВИЕ из закона ГЕССА: РАСЧЕТ ∆H⁰реакции, используя справочные данные ∆H⁰обр Тепловой эффект (энтальпия) реакции равна разности
- 48. Примеры термохимических расчетов
- 49. Примеры термохимических расчетов
- 50. Примеры термохимических расчетов
- 51. Примеры термохимических расчетов Энергия химической связи Eх.с – энергия, которую нужно затратить, чтобы превратить один моль
- 52. II начало термодинамики. Энтропия ВТОРО́Е НАЧА́ЛО ТЕРМОДИНА́МИКИ, один из основных законов термодинамики, устанавливающий необратимость реальных термодинамических
- 53. II начало термодинамики. Энтропия Формулировки второго начала термодинамики: «Невозможен процесс, единственным конечным результатом которого является превращение
- 54. II начало термодинамики. Энтропия Термодинамическое определение энтропии: Энтропией называется отношение теплоты, подводимой к термодинамической системе в
- 55. Энтропия-мера статистического беспорядка в изолированной термодинамической системе. термодинамическая вероятность W >> 1, S>0 R = 8,31
- 56. III. Направление реальных процессов. Свободная Энергия Гиббса Направление реальных процессов является итогом конкуренции двух противоположных факторов:
- 57. Направление реальных процессов. Свободная Энергия Гиббса Функция, которая является однозначным критерием направления процесса - это энергия
- 58. Критерии направления реакций
- 59. Использование значений ∆G на практике при нестандартных условиях На практике условия чаще всего нестандартные. Однако и
- 60. Стандартная Энергия Гиббса образования, ∆G⁰обр Стандартная энергия Гиббса образования вещества (∆G°298) – изменение ∆G реакции образования
- 61. Способы расчета ∆G°реакц Рассчитать изменение энергии Гиббса реакции ∆G°реакц )можно двумя способами. Первый способ - по
- 62. Приближенный метод расчета ∆G°реакц, Т для любой температуры Данный способ справедлив для реакций, в которых в
- 63. Основные понятия Условие химического равновесия. Химический потенциал и активность компонентов Закон действующих масс Термодинамические и концентрационные
- 64. Химическое равновесие
- 65. Условия равновесия (химического, фазового) наиболее простым и универсальным способом выражаются через химические потенциалы μ . Для
- 66. III. ХИМИЧЕСКИЙ ПОТЕНЦИАЛ, μ Химический потенциал данного вещества, μi n-число моль остальных компонентов
- 67. ХИМИЧЕСКИЙ ПОТЕНЦИАЛ, μ Химический потенциал данного вещества в многокомпонентной системе, μi - это величина энергии Гиббса
- 68. СВОЙСТВА ХИМИЧЕСКОГО ПОТЕНЦИАЛ, μ
- 70. Активность компонентов системы Активность компонентов – функция, определяющая свойства реальных систем, заменяющая собой концентрацию, имеющая размерность
- 71. ЗДМ химической реакции: Связь между концентрационной и термодинамической константами равновесия Термодинамическая константа равновесия, const при T=const
- 72. Выводы: Термодинамическая константа равновесия Ка не зависит от активности (концентрации) и давления системы, а определяется лишь
- 73. Примеры записи выражений ЗДМ для реакций
- 74. Примеры записи выражений ЗДМ для реакций
- 75. Примеры записи выражений ЗДМ для реакций
- 76. Примеры записи выражений ЗДМ для реакций
- 77. ХИМИЧЕСКИЕ РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ Равновесие диссоциации воды. Водородный показатель Равновесие диссоциации слабых кислот и оснований.
- 78. Диссоциация слабых многовалентных оснований и многоосновных кислот протекает по ступеням. Причем каждая последующая ступень протекает слабее
- 79. Равновесие диссоциации слабых электролитов
- 80. Равновесие диссоциации слабых электролитов
- 81. Произведение растворимости (ПР) PbI2(тв) III. Равновесие в растворах малорастворимых веществ
- 82. PbI2(тв) III. Равновесие в растворах малорастворимых веществ
- 83. Произведение растворимости (ПР) PbI2(тв) III. Равновесие в растворах малорастворимых веществ
- 84. Растворимость соли ( ), [ ] = [моль/л] – максимальная (предельная) концентрация растворённого вещества при данной
- 85. Гидролиз солей I, II, III – валентных металлов и одно- , двух- и трёхосновных кислот протекает
- 86. Полному необратимому гидролизу подвергаются только соли, образованные слабой, неустойчивой кислотой и и малорастворимым основанием: либо сульфиды,
- 87. Выводы: Гидролиз кислых или основных солей протекает по первой ближайшей ступени:
- 88. ХИМИЧЕСКАЯ КИНЕТИКА Общие закономерности Основные понятия Молекулярность и порядок реакции Основной закон химической кинетики. Зависимость скорости
- 89. 1. ОСНОВНЫЕ ПОНЯТИЯ: 1.1. СКОРОСТЬЮ ХИМИЧЕСКОЙ РЕАКЦИИ называется изменение количества одного из реагирующих веществ в единицу
- 91. Изменения количеств реагентов относятся, как стехиометрические коэффициенты 1.2. , Отсюда и скорость химической реакции
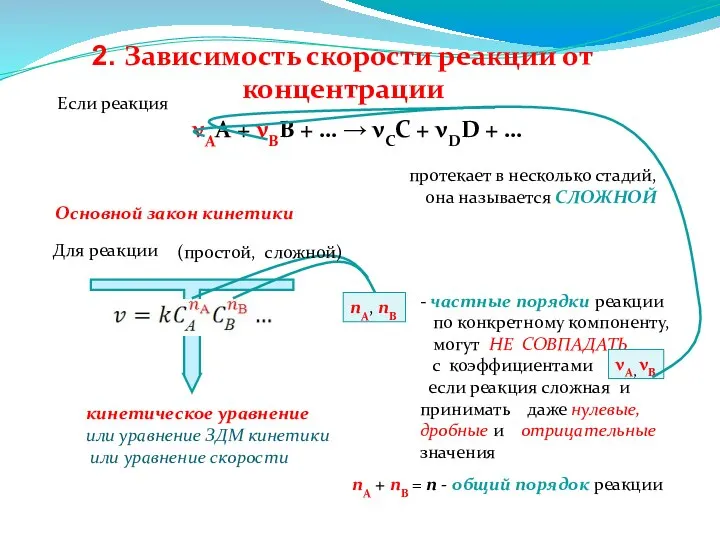
- 92. Если реакция νАА + νВВ + … → νСС + νDD + … протекает в несколько
- 93. УРАВНЕНИЕ СКОРОСТИ РЕАКЦИИ ПЕРВОГО ПОРЯДКА. ПЕРИОД ПОЛУРАСПАДА . К реакциям первого порядка относятся реакции фотохимической диссоциации,
- 94. УРАВНЕНИЕ СКОРОСТИ РЕАКЦИИ ПЕРВОГО ПОРЯДКА. ПЕРИОД ПОЛУРАСПАДА . период полупревращения (полураспада) реакции первого порядка !!! Период
- 95. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ПРИРОДЫ РЕАГЕНТОВ И ТЕМПЕРАТУРЫ Уравнение Аррениуса
- 97. Скачать презентацию











![Особенность электронного строения 90Th […6s26p6 ]5f06d2 7s2 !!! U [… 6s 26p6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/929191/slide-16.jpg)






























































![Растворимость соли ( ), [ ] = [моль/л] – максимальная (предельная) концентрация](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/929191/slide-83.jpg)










 Органическая химия
Органическая химия Основной государственный экзамен. Химия 2021. Задание 17
Основной государственный экзамен. Химия 2021. Задание 17 Аналитическая химия как наука. Лекция 1
Аналитическая химия как наука. Лекция 1 Термохимическое уравнение реакции полного сгорания ацетилена
Термохимическое уравнение реакции полного сгорания ацетилена Ниобий. Химические свойства
Ниобий. Химические свойства Пропитка рубинов и сапфиров
Пропитка рубинов и сапфиров Алкины. Ацетилен
Алкины. Ацетилен Скорость химических реакций
Скорость химических реакций Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН
Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН Презентация на тему Электролитическая диссоциация
Презентация на тему Электролитическая диссоциация  Галогены. Возможные степени окисления
Галогены. Возможные степени окисления ATOMPP
ATOMPP Урок по теме Алюминий .Строение.Свойства. Учитель: Деревянко Н.Г.
Урок по теме Алюминий .Строение.Свойства. Учитель: Деревянко Н.Г. Презентация на тему Уравнение Менделеева-Клапейрона
Презентация на тему Уравнение Менделеева-Клапейрона  Азотсодержащие органические соединения
Азотсодержащие органические соединения Кинетика физико-химических процессов
Кинетика физико-химических процессов Аналитический обзор по теме Процесс разложения аммиака
Аналитический обзор по теме Процесс разложения аммиака Спирты и фенолы. (Лекция 6.1)
Спирты и фенолы. (Лекция 6.1) Спирты. Классификация спиртов
Спирты. Классификация спиртов Образование растворов ВМС
Образование растворов ВМС Стеклообразование, структура и свойства стекол системы Na2O – B2O3 – SiO2 на основе комплексного борсодержащего сырья
Стеклообразование, структура и свойства стекол системы Na2O – B2O3 – SiO2 на основе комплексного борсодержащего сырья Сложные эфиры. Жиры
Сложные эфиры. Жиры Способы разделения смесей. Урок в 8 классе
Способы разделения смесей. Урок в 8 классе Химический состав живых организмов. Метаболизм
Химический состав живых организмов. Метаболизм Альдегиды
Альдегиды Чистые вещества и смеси. Классификация веществ. Оксиды
Чистые вещества и смеси. Классификация веществ. Оксиды Алканы. Строение,номенклатура, изомерия
Алканы. Строение,номенклатура, изомерия Биологическое окисление
Биологическое окисление