Основные понятия термодинамики.Первое начало термодинамики и его применимость к биосистемам. (Лекция 04)
Содержание
- 2. … научная дисциплина, которая устанавливает точные соотношения между энергией и свойствами системы, не требуя каких-либо сведений
- 3. Главная задача – научиться производить термодинамические расчёты и по результату делать выводы о направлении реакции и
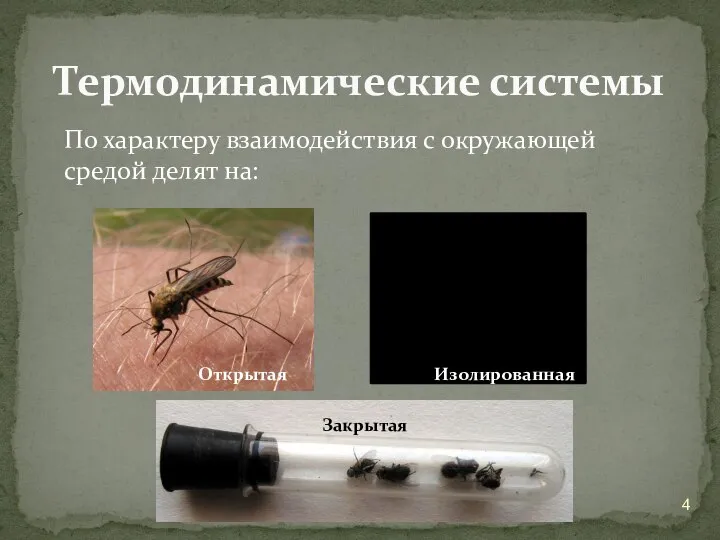
- 4. По характеру взаимодействия с окружающей средой делят на: Термодинамические системы Открытая Изолированная Закрытая
- 5. Н − энтальпия − тепловой эффект образования 1 моль вещества из простых веществ при р=const. Е(U)
- 6. … одна из форм закона сохранения энергии. Его формулировки: 1. Энергия не создаётся и не уничтожается,
- 7. Первый закон термодинамики в приложении к химическим реакциям ΔH = ΔE + pΔV Теплота, подведённая к
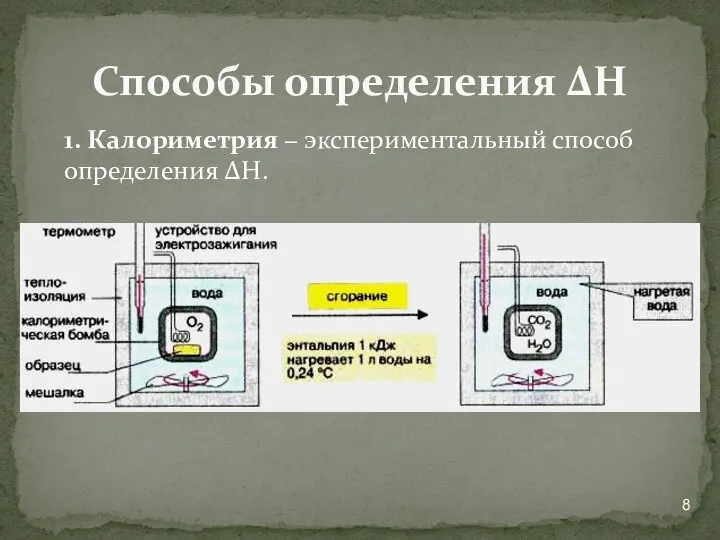
- 8. 1. Калориметрия − экспериментальный способ определения ΔН. Способы определения ΔН
- 9. 2. Закон Гесса − изменение энтальпии в химической реакции зависит только от вида и состояния исходных
- 10. 3. Следствия из закона Гесса I-ое следствие: II-ое следствие: Способы определения ΔН Реакция сгорания – процесс
- 11. Изменение энтальпии (ΔН) прямо пропорционально количеству исходных веществ и продуктов. Значение ΔН прямой реакции равно по
- 12. Для расчёта уровня основного обмена в организме. Основной обмен – скорость выделения организмом тепла в состоянии
- 13. Калорийность пищевых продуктов, представленная в виде их Е эквивалента
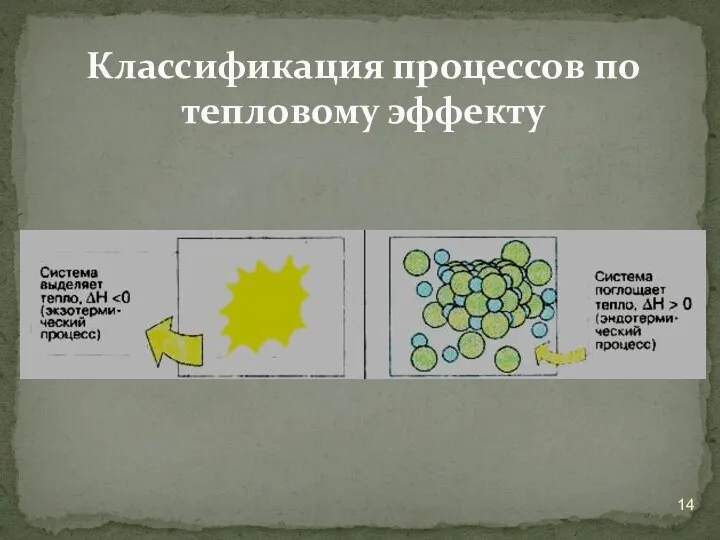
- 14. Классификация процессов по тепловому эффекту
- 16. Скачать презентацию










 Основания. Как называют основания?
Основания. Как называют основания? История развития химии
История развития химии Презентация на тему Неорганические полимеры
Презентация на тему Неорганические полимеры  Элемент протактиний
Элемент протактиний Вывод и обсуждение
Вывод и обсуждение Сухой метод определения глюкозы. Глюкометры
Сухой метод определения глюкозы. Глюкометры Химические реакции
Химические реакции Кроссворд. Плотность
Кроссворд. Плотность Презентация на тему Коррозия металлов
Презентация на тему Коррозия металлов  Тест 1 задание
Тест 1 задание Оксиды азота
Оксиды азота Золото. Физические свойства золота
Золото. Физические свойства золота Катаболизм пуриновых нуклеотидов
Катаболизм пуриновых нуклеотидов Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9
Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9 Химические уравнения. 8 класс
Химические уравнения. 8 класс Анализ катионов и анионов. Лекция № 2
Анализ катионов и анионов. Лекция № 2 Пакет заданий №2. Команда вечерний дозор
Пакет заданий №2. Команда вечерний дозор Свойства основных липопротеинов (ЛП) плазмы крови
Свойства основных липопротеинов (ЛП) плазмы крови Электронное строение атомов бора и фосфора
Электронное строение атомов бора и фосфора h-m-chniy-zv-yazok-budova-rechovin
h-m-chniy-zv-yazok-budova-rechovin Лекция 2 Классы неорганических соединений (1)
Лекция 2 Классы неорганических соединений (1) Основы аналитической химии
Основы аналитической химии Презентация на тему Дисперсные системы
Презентация на тему Дисперсные системы  Презентация на тему Алканолы - Предельные одноатомные спирты
Презентация на тему Алканолы - Предельные одноатомные спирты  Путешествие по городу химиков
Путешествие по городу химиков Термодинамика. Лекция №2
Термодинамика. Лекция №2 Prezentatsia_Microsoft_PowerPoint
Prezentatsia_Microsoft_PowerPoint Вредна ли губная помада
Вредна ли губная помада